Метилэтиленгликоль: Чем отличается моноэтиленгликоль от этиленгликоля?
Чем отличается моноэтиленгликоль от этиленгликоля?
Промывка- Промывка
- Промывка труб отопления
- Промывка теплоносителей
- Промывка кондиционера
- Промывка вентиляции
- Промывка пластинчатых теплообменников
- Промывка систем холодоснабжения

На самом деле вопрос “чем отличается моноэтиленгликоль от этиленгликоля” звучит несколько странно, но поскольку задавался он многократно, то будет неправильно игнорировать его. Этиленгликоль и моноэтиленгликоль — одно и то же. Очень часто это вещество называют просто МЭГ. Напоминает женское имя, даже чем-то романтично, но не будем отвлекаться.
Этиленгликоль суров и предсказуем. Это токсичное вещество с неизменными физическими и химическими свойствами (мы имеем в виду концентрат без всяких примесей и добавок, которые могут изменять характеристики двухатомного спирта). Оно не имеет ни цвета, ни запаха. При попадании внутрь вызывает сильнейшее отравление, вплоть до летального исхода.
Температура воспламенения высокая +124 градуса. Гигроскопичность, негорючесть и другие свойства этиленгликоля дают промышленникам широкие возможности для использования простейшего вещества.
Применение этиленгликоля (моноэтиленгликоля): факты, о которых вы не знали
МЭГ входит в состав не только антифризов и различных гидравлических жидкостей, а даже таких вещей, которыми вы пользуетесь ежедневно.
Лак и смывка для ногтей, ткани и крема для обуви, целлофан и полимеры, обычное средство для мытья стекол — все это часто изготавливается с применением этиленгликоля. Вы каждый день носите многие из них с собой, даже не подозревая, что прозрачная ядовитая тягучая жидкость оставила свой след в совершенно обыденном предмете. Конечно, в швейной и других видах промышленности, которые предполагают тесный контакт изделий с человеком, строжайше соблюдается техника безопасности и учитываются условия их использования. Бояться не нужно. От прикосновения к пакету ничего с вами не случится.
Интересные статьи
1-O-метилэтиленгликоль, структурная формула, химические свойства
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий неметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Этиленгликоль — Википедия. Что такое Этиленгликоль
| Этиленгликоль | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | этандиол-1,2 |
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Хим. формула | C2H6O2 |
| Рац. формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 62,068 г/моль |
| Плотность | 1,113 г/см³ |
| Термические свойства | |
| Т. плав. | −12,9 °C |
| Т. кип. | 197,3 °C |
| Т. всп. | 111 °C |
| Пр. взрв. | 3,2 ± 0,1 об.%[1] |
| Давление пара | 0,06 ± 0,01 мм рт.ст.[1] |
| Химические свойства | |
| pKa | 15,1 ± 0,1[2] |
| Оптические свойства | |
| Показатель преломления | 1,4318 |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| PubChem | 174 |
| Рег. номер EINECS | 203-473-3 |
| SMILES | |
| InChI | |
| RTECS | KW2975000 |
| ChEBI | 30742 |
| ChemSpider | 13835235 |
| Безопасность | |
| ПДК | 5 мг/м3 |
| ЛД50 | 4700 мг/кг (крысы, перорально) |
| Токсичность | умеренно токсичен   |
| R-фразы | R22 |
| H-фразы | h402 |
| P-фразы | P264, P270, P301+P312, P330, P501 |
| Пиктограммы СГС |  |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.[3]
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
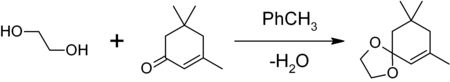
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[4] или комплекса диметилсульфат-ДМФА[5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль токсичен[6][7]. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела)[8]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол[9].
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой[10].
См. также
Примечания
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0272.html
- ↑ P. Ballinger, Long F. A. Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds 1,2 // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1960. — Vol. 82, Iss. 4. — P. 795–798. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01489A008
- ↑ Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol
- ↑ SYNTHESIS 1983, No 3,pp 203—205
- ↑ Liebigs Annalen Chemie 1979, pp 1362—1369
- ↑ https://www.cdc.gov/niosh/ershdb/emergencyresponsecard_29750031.html
- ↑ http://www.sciencelab.com/msds.php?msdsId=9927167
- ↑ Е.Ю.Бонитенко и др. Отравления этиленгликолем и его эфирами – СПб.: «Изд-во НИИХ СПбГУ», 2003 г. — Medline.Ru
- ↑ Flomenbaum, Goldfrank et al. Goldfrank’s Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0071437630.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6 000 экз. — ISBN 5-11-000148-0.
Ссылки
метилэтиленгликоль — с русского на английский
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАнглийскийТатарскийКазахскийУкраинскийВенгерскийТаджикскийНемецкийИвритНорвежскийКитайскийФранцузскийИтальянскийПортугальскийТурецкийПольскийАрабскийДатскийИспанскийЛатинскийГреческийСловенскийЛатышскийФинскийПерсидскийНидерландскийШведскийЯпонскийЭстонскийЧеченскийКарачаевскийСловацкийБелорусскийЧешскийАрмянскийАзербайджанскийУзбекскийШорскийРусскийЭсперантоКрымскотатарскийСуахилиЛитовскийТайскийОсетинскийАдыгейскийЯкутскийАйнский языкЦерковнославянский (Старославянский)ИсландскийИндонезийскийАварскийМонгольскийИдишИнгушскийЭрзянскийКорейскийИжорскийМарийскийМокшанскийУдмурдскийВодскийВепсскийАлтайскийЧувашскийКумыкскийТуркменскийУйгурскийУрумскийЭвенкийскийБашкирскийБаскский
метилэтиленгликоль — со всех языков на русский
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАлтайскийАрабскийАварскийАймараАзербайджанскийБашкирскийБелорусскийБолгарскийКаталанскийЧеченскийЧаморроШорскийЧерокиЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийДатскийНемецкийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГалисийскийКлингонскийЭльзасскийИвритХиндиХорватскийГаитянскийВенгерскийАрмянскийИндонезийскийИнгушскийИсландскийИтальянскийИжорскийЯпонскийЛожбанГрузинскийКарачаевскийКазахскийКхмерскийКорейскийКумыкскийКурдскийЛатинскийЛингалаЛитовскийЛатышскийМокшанскийМаориМарийскийМакедонскийМонгольскийМалайскийМальтийскийМайяЭрзянскийНидерландскийНорвежскийОсетинскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПуштуПортугальскийКечуаКвеньяРумынский, МолдавскийРусскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиТамильскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВодскийВьетнамскийВепсскийИдишЙорубаКитайский
метилэтиленгликоль — с английского на все языки
Все языкиАбхазскийАдыгейскийАфрикаансАйнский языкАканАлтайскийАрагонскийАрабскийАстурийскийАймараАзербайджанскийБашкирскийБагобоБелорусскийБолгарскийТибетскийБурятскийКаталанскийЧеченскийШорскийЧерокиШайенскогоКриЧешскийКрымскотатарскийЦерковнославянский (Старославянский)ЧувашскийВаллийскийДатскийНемецкийДолганскийГреческийАнглийскийЭсперантоИспанскийЭстонскийБаскскийЭвенкийскийПерсидскийФинскийФарерскийФранцузскийИрландскийГэльскийГуараниКлингонскийЭльзасскийИвритХиндиХорватскийВерхнелужицкийГаитянскийВенгерскийАрмянскийИндонезийскийИнупиакИнгушскийИсландскийИтальянскийЯпонскийГрузинскийКарачаевскийЧеркесскийКазахскийКхмерскийКорейскийКумыкскийКурдскийКомиКиргизскийЛатинскийЛюксембургскийСефардскийЛингалаЛитовскийЛатышскийМаньчжурскийМикенскийМокшанскийМаориМарийскийМакедонскийКомиМонгольскийМалайскийМайяЭрзянскийНидерландскийНорвежскийНауатльОрокскийНогайскийОсетинскийОсманскийПенджабскийПалиПольскийПапьяментоДревнерусский языкПортугальскийКечуаКвеньяРумынский, МолдавскийАрумынскийРусскийСанскритСеверносаамскийЯкутскийСловацкийСловенскийАлбанскийСербскийШведскийСуахилиШумерскийСилезскийТофаларскийТаджикскийТайскийТуркменскийТагальскийТурецкийТатарскийТувинскийТвиУдмурдскийУйгурскийУкраинскийУрдуУрумскийУзбекскийВьетнамскийВепсскийВарайскийЮпийскийИдишЙорубаКитайский
Все языкиРусскийПерсидскийИспанскийИвритНемецкийНорвежскийИтальянскийСуахилиКазахскийНидерландскийХорватскийДатскийУкраинскийКитайскийКаталанскийАлбанскийКурдскийИндонезийскийВьетнамскийМаориТагальскийУрдуИсландскийВенгерскийХиндиИрландскийФарерскийПортугальскийФранцузскийБолгарскийТурецкийСловенскийПольскийАрабскийЛитовскийМонгольскийТайскийПалиМакедонскийКорейскийЛатышскийГрузинскийШведскийРумынский, МолдавскийЯпонскийЧешскийФинскийСербскийСловацкийГаитянскийАрмянскийЭстонскийГреческийАнглийскийЛатинскийДревнерусский языкЦерковнославянский (Старославянский)АзербайджанскийТамильскийКвеньяАфрикаансПапьяментоМокшанскийЙорубаЭрзянскийМарийскийЧувашскийУдмурдскийТатарскийУйгурскийМалайскийМальтийскийЧерокиЧаморроКлингонскийБаскский
Этиленгликоль фталаты его — Справочник химика 21
Этиленгликоль широко применяется как в качестве анти- фриза, так и для изготовления сложных эфиров, неорганических и органических кислот. Известно, что динитрат этиленгли-коля является важным взрывчатым веществом, входящим в состав динамита. Ацетаты и фталаты этиленгликоля являются пластификаторами. Этиленгликоль с двухосновными органическими кислотами образует полиэфиры с высоким молекулярным [c.16]Терефталевая кислота (, 4-бензендикарбоновая, или п-фтале-вая) легко образует диметиловый эфир, который при взаимодействии с этиленгликолем дает полимерный продукт — полиэтилентере-фталат, используемый при производстве искусственного волокна — лавсана [c.324]
Для достижения более высокой вязкости важно до полимеризации как можно. полнее удалить с током азота последние следы метанола. При использовании тере-фталата этиленгликоля полимеризационная смесь может быть оставлена на этой стадии на ночь С более неустойчивыми мономерами нагревание можно сократить [c.27]
ЭХГ, ДФП, амины, ангидриды дикарбоновых кислот, ацетон, толуол, этиленгликоль, фталаты и др. [c.55]
Как показали исследования Рейнольдса и сотрудников , ди-(бутил-этиленгликоль)-фталат очень хорошо растворяет хлоркаучук. При малой дозировке этого эфира пленки становятся мягкими, при небольшом увеличении дозировки пластификатора они становятся жестче, а затем снова размягчаются. [c.780]
Фенилсалицилат можно применять в качестве стабилизатора этой системы, несмотря на его сравнительно большую летучесть 1 . Нанесенные на алюминий лаковые пленки из триацетата целлюлозы, пластифицированного триацетином, подвергали искусственному старению 1 . Испытание заключалось в том, что образцы выдерживали 3 суток нри 70 °С, погружали на 2 суток в воду при 30 °С и 15 суток облучали УФ-лучами. В этих условиях триацетин оказался совершенно непригодным. Аналогичные результаты были получены для таких нленок в трехмесячных опытах естественного старения. При применении бутилтартрата пленка не выдерживает УФ-облучения. Трудноокисляющиеся покрытия можно получить, использовав в качестве пластификаторов смеси трифенилфосфата с 1 /3 бутилтартрата или монометилового эфира этиленгликоль-фталата. Результаты ускоренных испытаний пленок, содержагцих такие смеси пластификаторов, подтверждены одногодичными опытами естественного старения. [c.232]
Этиленгликоль применяют в основном в качестве антифриза для двигателей внутреннего сгорания, например в автомобилях или самолетах. Он гораздо менее летуч, чем метиловый спирт, и имеет меньший молекулярный вес, чем глицерин. Этиленгликоль используют также для производства различных сложных эфиров как органических, так и неорганических кислот. Динитрат этиленгликоля — взрывчатое вещество, входящее в состав динамитов, замерзающих при низкой температуре. Ацетаты и фталаты этиленгликоля служат пластификаторами. Их можно также получить непосредственно из окиси этилена и соответствующей кислоты или ее ангидрида (стр. 363). [c.355]
П оли этиленгликоль- изо- фталат Поли-1,2-этандиол-иэо-фталат Полиэтиленгликолевый эфир изо-фталевой кислоты 1,2-Этандиол-изо—фталат Этиленгликолевый эфир изо-фталевой кислоты [c.413]
Диметилтерефталат, этиленгликоль Полиэтилентере- фталат Окись свинца [300] = [c.332]
Эти данные остаются справедливыми для высушенных пленок, полученных из раствора . Однако максимальная совместимость в пленке после воздействия на нее воды, горячего воздуха или атмосферных явлений отличается от указанной начальной максимальной совместимости. Ди-(метилэтиленгликоль)-фталат длительно удерживается ацетатом целлюлозы, содержащим 59% СН3СООН в количестве, не превышающем 25%. Такие пленки, отличающиеся высокой эластичностью, нерастворимы в маслах и бензине, свето- и теплостойки. Обычно из ацетата целлюлозы готовят массы для литья под давлением, добавляя 10—40% ди-(метил-этиленгликоль)-фталата. По патентным данным , рекомендуется применять при переработке ацетата целлюлозы, содержащего 56—58% СН3СООН, смесь ди-(метилэтиленгликоль)-фталата с твердыми пластификаторами, образующими гели, например с трифенилфосфатом или толуолсульфамидами. [c.778]
Поэтому, несмотря на то, что с ди-(метилэтиленгликоль)-фталатом получаются очень эластичные плепки нитрата целлюлозы, его применяют сравнительно редко. Вторичный ацетат целлюлозы не растворяется в, ди-(этиленгликоль)-фталате даже при температурах до 180° С. Однако с сильно гидролизованным ацетатом целлюлозы он совмеш ается в довольно больших количествах (до 70%). Все же Фордайс и Мейер рекомендуют применять его в количестве, не превышающем 25%, для того чтобы не вызвать слишком заметного снижения водостойкости. Несмотря на не очень высокую светостойкость ди-(этилэтилепгликоль)-фталата, его широко используют для пластификации этилцеллюлозы, главным образом вследствие присущей ему бензиностойкости. Такие массы отличаются умеренной водостойкостью. Температура стеклования этилцеллюлозных масс, пласти-фрщированных этим фталатом —34° С (данные Нильсена и сотрудников). [c.779]
Не рекомендуется применять ди-(бутилэтиленгликоль)-фталат при переработке ацетилцеллюлозы. Хорошие результаты были получены при переработке с этим эфиром смешанных эфиров целлюлозы с уксусной и высшими н ирпыми кислотами (табл. 262, стр. 753), несмотря на то, что он обладает меньшей растворяющей способностью, чем фталаты низших спиртов, и поэтому его нужно вводить в больших дозировках. Относительное удлинение пленок при этом увеличивается, а пределы прочности при растяжении и при многократном изгибе заметно снижаются. Ди-(бутил-этиленгликоль)-фталат можно с успехом вводить и в этилцеллюлозу. Для пластификации пластической массы, содержащей около 100% наполнителя, требуется примерно 35% фталата. [c.779]
В промышленности наибольшее распространение получил метод переэтерификации диметилтере-фталата этиленгликолем с последующей поликои-денсацией дигликольтерефталата по схеме [c.74]
Напишите реакцию взаимодействия диметилтере-фталата с этиленгликолем. Какое практическое значение имеет эта реакция [c.154]
Большое значение нмеют также 5азнообразные полимер л полиэфирного типа. В качестве примера рассмотрим полиэтилентере-фталат — высокомолекулярный сложный эфир этиленгликоля и терефталевой кислоты [c.335]
Однако выделяющаяся при поликонденсации вода уносит с собой значительные количества летучего при температуре реакции этиленгликоля, что нарушает необходил1ую эквимолекулярность в соотношении компонентов [89]. Поэтому в качестве исходного продукта для поликондепсации используют диэфир этиленгликоля и терефталевой кислоты ди-(р-оксиэтил)-тере фталат
Метиленгликоль в утюжках для волос

Контекст — Метиленгликоль — ингредиент, используемый в некоторых средствах для выпрямления волос. Он образуется при реакции формальдегида с водой. Формальдегид — токсичное вещество, и, поскольку реакция с водой обратима, продукты, содержащие метиленгликоль, могут при некоторых обстоятельствах выделять формальдегид.
Возникает вопрос: безопасно ли использование метиленгликоля в средствах для выпрямления волос?
- Исходный документ: SCCS (2012)
- Сводка и детали: GreenFacts
Что такое метиленгликоль?
Растворенная в воде молекула формальдегида, представляющего собой газ, при комнатной температуре реагирует с молекулой воды с образованием метиленгликоля.Эту реакцию легко обратить вспять в различных условиях. Оба соединения существуют в равновесии и постоянно и быстро превращаются друг в друга. Скорость превращения зависит от температуры, pH, концентрации и присутствия других молекул. Поэтому, хотя химически это две разные молекулы, Научный комитет по безопасности потребителей считает, что метиленгликоль в растворе эквивалентен формальдегиду.
Как потребители подвергаются воздействию метиленгликоля?
В настоящее время метиленгликоль используется в средствах для выпрямления волос, его концентрация может достигать 9.6% в некоторых случаях. Это намного превышает установленный предел для формальдегида, который составляет 0,2%. Использование этих продуктов также включает нагревание и нанесение выпрямляющим утюгом или феном, который может выделять пары формальдегида. Выпрямители для волос обычно используются в парикмахерских, и некоторые специалисты по волосам потенциально могут подвергаться значительному воздействию этих паров формальдегида.
Каковы потенциальные последствия воздействия формальдегида на здоровье?
Формальдегид раздражает глаза, кожу и дыхательные пути при вдыхании.Вдыхание высоких концентраций формальдегида может вызвать рак носа и горла у экспериментальных животных. Воздействие формальдегида также было связано с лейкемией у людей. Основываясь на имеющихся научных данных, Международное агентство по изучению рака (IARC) Всемирной организации здравоохранения (ВОЗ) классифицировало формальдегид как потенциальный канцероген для человека.
Безопасно ли использование метиленгликоля в выпрямителях для волос?
В настоящее время существуют ограничения на использование формальдегида в косметике, но ни в одном из них явно не упоминается метиленгликоль в средствах для выпрямления волос.Научное мнение Научного комитета по безопасности потребителей заключается в том, что, когда метиленгликоль используется в средствах для выпрямления волос в концентрации 0,2%, количество выделяемых паров формальдегида может превышать рекомендованный ВОЗ по качеству воздуха в помещении 0,1 мг / м 3 , и представляют опасность для здоровья. Таким образом, Комитет пришел к выводу, что использование средств для выпрямления волос на основе метиленгликоля на таких низких уровнях, как допустимая в настоящее время концентрация формальдегида в 0,2%, не считается безопасным.
Этот информационный бюллетень основан на научном заключении «Метиленгликоль», принятом 26-27 июня 2012 года независимым Европейским научным комитетом по безопасности потребителей.
.Метиленгликоль — Купите метиленгликоль, завод по производству пропиленгликоля, продукт пропиленгликоля Pg Tech Grade в химических продуктах на Alibaba.com
99,7% Цена на пропиленгликоль, класс PG tech, C3H8O2
пропиленгликоль
ведущий производитель и поставщик ISO
чистота: 99,5%
бесцветная вязкая жидкость без запаха
: Пропиленгликоль; 1,2-пропандиол
2.Молекулярная формула: C3H8O2
3. Относительная молекулярная масса: 76,09
4. Относительная плотность 20/20 г / см3: 1.0351.039
5. Диапазон дистилляции 95%, об.: 184190
9 .Внешний вид: Бесцветная прозрачная или желтая жидкость со специфическим вкусом
7. Пропиленгликоль (PG C3H8O2) — бесцветная жидкость с постоянной вязкостью и хорошим водопоглощением. Он почти не имеет запаха, негорючий и почти не токсичен.Его можно смешивать и растворять со спиртом, водой и различными органическими веществами.
8.PG является сырьем для получения ненасыщенной полиэфирной смолы, пластификатора, поверхностно-активного вещества, эмульгатора и деэмульгирующего агента. Его также можно использовать в качестве ингибитора плесени, антисептика для фруктов, ингибитора льда и сохраняющего влагу агента для табака.
Формула: C3H8O2 Мол. Масса: 76,1 FEMA # 2940 CAS # 57-55-6 | ||||
Цвет и внешний вид | Бесцветная вязкая прозрачная жидкость. | |||
Запах | Сладкий, горький вкус без прогорклого запаха. | |||
Анализ (%) | ≥99,5 | |||
Диапазон кипения | ISP (° C) | ≥185 | ||
DP (° C) | ≤189 | |||
Относительная плотность (25/25 ° C) | 1,0350 ~ 1.0370 | |||
Вода (%) | ≤0,2 | |||
Кислотность | Пройдена проверка | |||
Остаток воспламенения (%) | 9007||||
Pb (мг / кг) | ≤1 | |||
Срок годности | 12 месяцев | |||
Упаковка | 215 кг / бочка | |||
Хранить в сухом прохладном месте, без хранения на открытом воздухе | ||||
9.Упаковка и хранение:
215 кг / бочка, флекситанк или по требованию клиента. Хранить в прохладном, сухом и защищенном от сквозняков месте
Пожалуйста, не стесняйтесь обращаться к нам, если у вас есть какие-либо вопросы о нашем пропиленгликоле.
.этиленгликоль | Свойства, применение и структура
Этиленгликоль , также называемый этан-1,2-диол , простейший представитель семейства органических соединений гликоля. Гликоль — это спирт с двумя гидроксильными группами на соседних атомах углерода (1,2-диол). Общее название этиленгликоль буквально означает «гликоль, полученный из этилена».
Подробнее по этой теме
спирт: этиленгликоль
Название этиленгликоль буквально означает «гликоль, сделанный из этилена.Его систематическое название — этан-1,2-диол. Этилен …
Этиленгликоль — прозрачная, сладкая, слегка вязкая жидкость, которая кипит при 198 ° C (388,4 ° F). Чаще всего он используется в качестве автомобильного антифриза. Раствор этиленгликоля и воды в соотношении 1: 1 кипит при 129 ° C (264,2 ° F) и замерзает при -37 ° C (-34,6 ° F), служа отличной охлаждающей жидкостью для автомобильных радиаторов. Этиленгликоль очень ядовит; животные или люди, которые пьют раствор, серьезно заболевают и могут умереть.
Помимо использования в антифризах, этиленгликоль используется в качестве ингредиента гидравлических жидкостей, типографских красок и растворителей для красок. Он также используется в качестве реагента при производстве полиэфиров, взрывчатых веществ, алкидных смол и синтетических восков.
Britannica Premium: удовлетворение растущих потребностей искателей знаний. Получите 30% подписки сегодня. Подпишись сейчас .| Лучший поставщик химикатов | |
| Качественный поставщик исследовательских химикатов и биохимических продуктов, включая ингибиторы, строительные блоки, продукты GMP, примеси и метаболиты, API для ветеринарии, природные соединения, ADC, молекулы стволовых клеток и хиральные соединения. | |
| BOC Sciences предоставляет широкий спектр услуг для поддержки фармацевтической промышленности на всех этапах открытия лекарств, включая индивидуальный синтез тех химикатов, которых нет на складе, услуги по маркировке изотопов, хиральный синтез и разрешение, биоконъюгирование, услуги ПЭГилирования, аналитические услуги. | |
| BOC Sciences — это торговая марка BOCSCI Inc. Мы используем широкий спектр деятельности в области разработки, производства, маркетинга и распространения, чтобы помочь вам принимать наиболее обоснованные решения с учетом ваших растущих потребностей в химикатах премиум-класса. Наш полный набор услуг CRO охватывает весь процесс разработки молекул, включая контрактные исследования для идентификации целей, строительных блоков, синтеза соединений, биохимического и клеточного анализа, доклинических испытаний на животных и клинических исследований. | |
| Эл. Почта: | Маркетинг |
| США Эл. Почта: | Маркетинг |
| Эл. Почта: | Продажи |
| США Эл. Почта: | Отдел продаж |
| Голосовой: 1-631-504-6093 | |
| Факс: 1-631-614-7828 | |
| Голос США: 1-631-504-6093 | |
| Факс в США: 1-631-614-7828 | |
| Европа | 44-203-286-1088 |
| Твиттер | |
| Блог | |
| Загрузите приложение! | |
| Продукт (ы): | |
| 463-57-0 Метандиол | |