Этиленгликоль свойства: Этиленгликоль (моноэтиленгликоль): химический состав и свойства, особенности, где используется
Этиленгликоль (моноэтиленгликоль): химический состав и свойства, особенности, где используется
Этиленгликоль (альтернативные названия – диоксиэтан, этандиол, моноэтиленгликоль) – представитель двухатомных спиртов. Химическая формула вещества – С2H6О2. Внешне это бесцветная прозрачная жидкость без запаха. По общепринятой международной классификации отнесен к третьему классу опасности. Употребление внутрь 100 мл этиленгликоля смертельно для человека. Пары диоксиэтана токсичны, попадание в чистом виде или в водном растворе опасно для здоровья и жизни.
Физические свойства этиленгликоля
- Молярная масса – 62 грамма/моль;
- Температура воспламенения зависит от концентрации: 112-124 градуса;
- Коэффициент оптического преломления – 1,4318;
- Температура самовоспламенения – 380 градусов;
- Температура замерзания чистого гликоля – минус 22 градуса;
- Температура кипения – 197,3 градуса;
- Плотность – 1,111 грамма на кубический сантиметр.

Физические и теплофизические свойства вещества зависят от концентрации в растворе. Высококонцентрированный гликоль выдерживает нагрев до высокой температуры, поэтому он подходит для теплоносителей инженерных систем. Низкая температура кристаллизации (достигает нижних пределов в 65 градусов ниже нуля примерно при 40 % в растворе) позволяет использовать диоксиэтан в качестве сырья для антифризов систем охлаждения.
История и современное производство
Этиленгликоль впервые синтезировал французский химик Вюрц в середине XIX века. Сырьем для получения гликоля стал сначала диацетат, а затем – этиленоксид. Первоначально синтезированное вещество не получило практического применения. Спустя 50 лет этиленгликоль активно использовали при производстве взрывчатых веществ. Низкая себестоимость производства, высокая плотность, подходящие физические характеристики позволили вытеснить глицерин, служивший для изготовления взрывчатки.
В промышленных масштабах двухатомный спирт начали производить в 20-ых годах прошлого столетия в США. Американские специалисты спроектировали и построили завод в Западной Вирджинии и наладили массовое изготовления гликоля. На протяжении долгих лет его закупали практически все крупные компании, специализирующиеся на изготовлении динамита.
Американские специалисты спроектировали и построили завод в Западной Вирджинии и наладили массовое изготовления гликоля. На протяжении долгих лет его закупали практически все крупные компании, специализирующиеся на изготовлении динамита.
Сегодня этиленгликоль в промышленных масштабах синтезируется в ходе гидратации этилена двумя способами:
- С применением низкоконцентрированной серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов;
- Под давлением в 10 атмосфер и температуре в 200 градусов.
На выходе получается смесь, содержащая до 90 процентов чистого высококонцентрированного этиленгликоля. Побочные продукты реакции – полимергомологи и триэтиленгликоль, нашли широкое применение в промышленности. Системы охлаждения воздуха, производство пластификаторов и препаратов для дезинфекции – наиболее популярные сферы использования.
Применение этиленгликоля в промышленности
- Реакции органического синтеза.
 Гликоль обладает высокой химической активностью, поэтому используется в качестве растворителя, средства защиты изофорона и карбонильных групп. Спирт не кипит при высоких температурах, за чет чего подходит для специальной авиационной жидкости. Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
Гликоль обладает высокой химической активностью, поэтому используется в качестве растворителя, средства защиты изофорона и карбонильных групп. Спирт не кипит при высоких температурах, за чет чего подходит для специальной авиационной жидкости. Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов. - Растворитель для красящих соединений.
- Производство взрывчатого вещества – нитрогликоля (более дешевый и доступный аналог нитроглицерина).
- Газодобывающая отрасль. Этиленгликоль исключает образование гидрата метана на трубах и поглощает излишнюю влагу.
- Криопротекция. Вещество активно используется при производстве жидкостей для охлаждения компьютерной и цифровой техники, изготовлении конденсаторов и получении 1,4-диоксина.
Охлаждающие жидкости на основе этиленгликоля
Двухатомный спирт используется при изготовлении антифризов для охлаждающих систем двигателя, теплоносителей инженерных систем отопления и кондиционирования воздуха. Раствор с деминерализованной водой и пакетом антикоррозионных присадок обладает антикавитационными и антипенными свойствами.
Раствор с деминерализованной водой и пакетом антикоррозионных присадок обладает антикавитационными и антипенными свойствами.
Преимущество этиленгликоля – низкая температура кристаллизации в сравнении с водой. Даже при достижении точки замерзания гликоль имеет более низкий коэффициент температурного расширения в сравнении с водой (на 1,5-3 % меньше). Высокая температура кипения позволяет использовать водно-гликолевую смесь в экстремальных производственных условиях, при подогревании нефти и газа и других технологических процессах.
Дополнительные преимущества антифризов на основе этиленгликоля:
- Разнообразие выбора концентраций для различных условий эксплуатации;
- Стабильные рабочие параметры и теплофизические свойства на протяжении длительного периода;
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Физические свойства этиленгликоля и глицерина :: HighExpert.RU
Этиленгликоль (этандиол, гликоль) — это простейший двухатомный спирт, его химическая формула HO-CH2CH2-OH. Этиленгликоль широко применяется в качестве антифриза, также используется в органическом синтезе. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Этиленгликоль не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен.
Этиленгликоль широко применяется в качестве антифриза, также используется в органическом синтезе. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Этиленгликоль не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен.
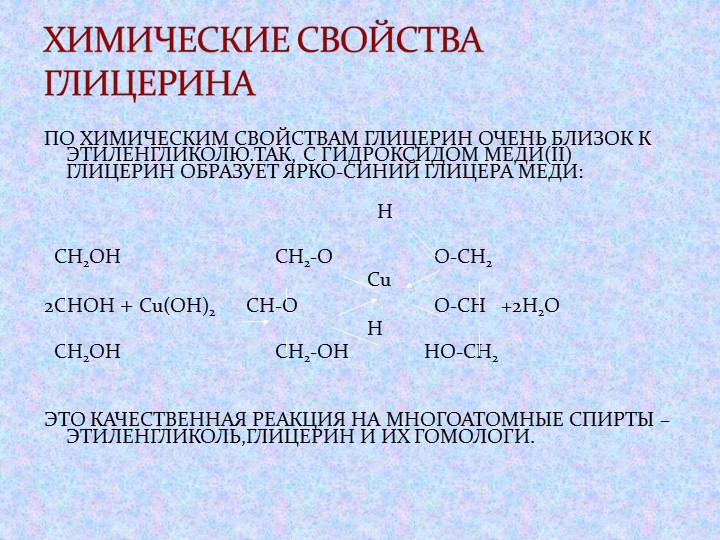
Глицерин (триоксипропан) — это простейший представитель трехатомных спиртов, его химическая формула HOCH2CH(OH)-CH2OH (C3H8O3). Глицерин находит широкое применение в при изготовлении бумаги, косметики и мыла, а также в производстве кондитерских изделий и алкогольных напитков; применяется в технологических процессах, предотвращает замораживание рабочих жидкостей, способствует продлению срока службы деталей из эластомеров. Глицерин является бесцветной вязкой жидкостью, неограниченно растворимой в воде. Обладает сладким вкусом.
Теплофизические свойства этиленгликоля
При нормальных условиях вязкость этиленгликоля в ~19 раз больше вязкости воды.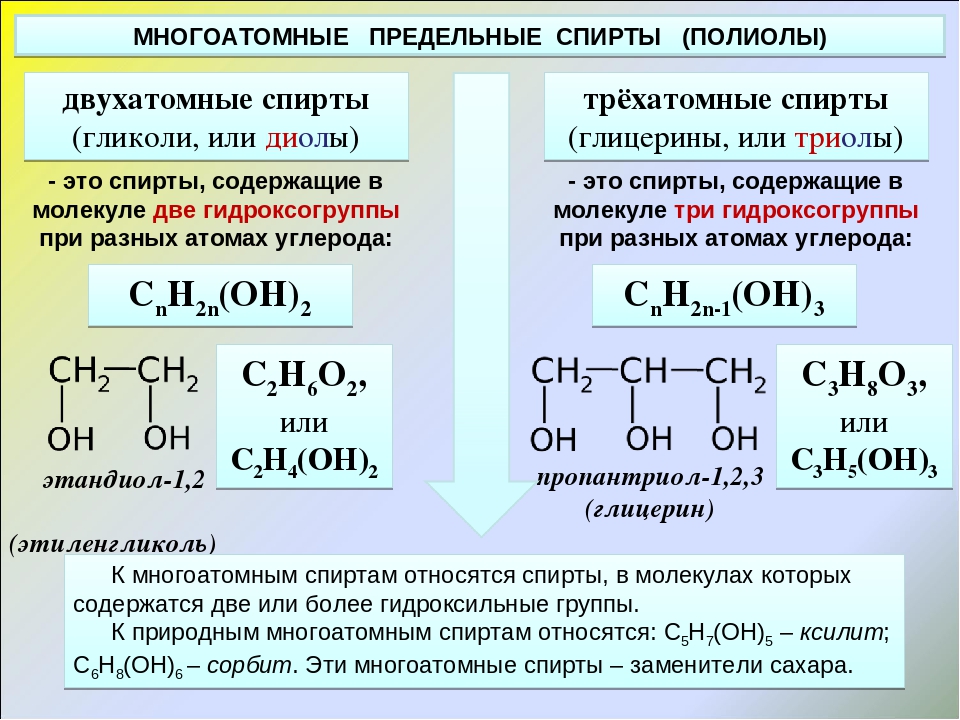 Теплофизические свойства водного раствора этиленгликоля зависят от его содержания в смеси.
Теплофизические свойства водного раствора этиленгликоля зависят от его содержания в смеси.| Температура | Плотность, ρ | Удельная теплоемкость, Cp | Кинематическая вязкость**, ν | Теплопроводность, λ | Коэффициент температуропроводности, a | Число Прандтля, Pr |
| оС | кг/м3 | кДж / (кг • К) | м2/с • 106 | Вт/(м • К) | м2/с • 107 | — |
| 0 | 1130,1 | 2,294 | 67,62 | 0,242 | 0,933 | 615,0 |
| 20 | 1116,1 | 2,382 | 19,17 | 0,249 | 0,938 | 204,0 |
| 40 | 1100,8 | 2,474 | 8,69 | 0,256 | 0,938 | 93,0 |
| 60 | 1087,1 | 2,562 | 4,75 | 0,260 | 0,931 | 51,0 |
| 80 | 1077,0 | 2,650 | 2,98 | 0,262 | 0,922 | 32,4 |
| 100 | 1057,9 | 2,742 | 2,03 | 0,263 | 0,908 | 22,4 |
При проведении инженерных расчётов проще использовать приближённые формулы для определения физических свойств этиленгликоля.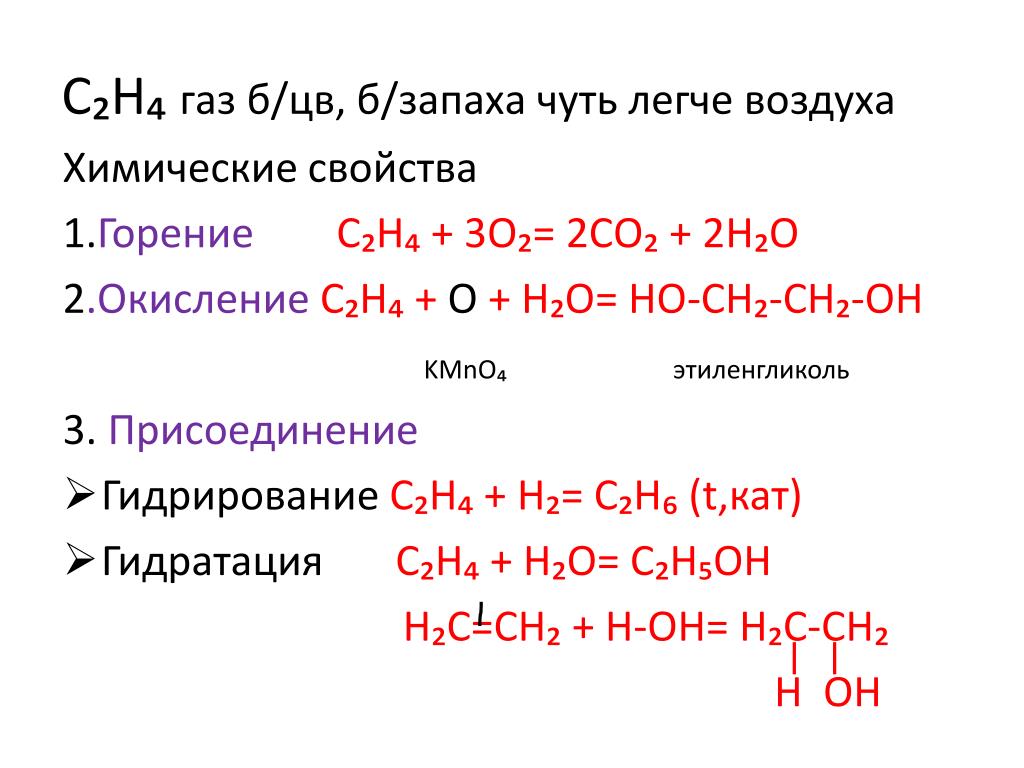
Плотность этиленгликоля
⋆ [ кг/м3 ]Теплоёмкость этиленгликоля
⋆ [ Дж/(кг • К) ]Теплопроводность этиленгликоля
⋆ [ Вт/(м • K) ]Кинематическая вязкость этиленгликоля
⋆ [ м2/с ]Температуропроводность этиленгликоля
[ м2/с ]Число Прандтля
[ — ]Динамическая вязкость этиленгликоля
[ Па • c ]Теплофизические свойства глицерина
В таблице приведены физические свойства глицерина, которые существенно зависят от температуры этой жидкости. При температуре +20 градусов Цельсия динамическая вязкость глицерина составляет около 1,41…1,48 Па•c и снижается в ~100 раз при повышении температуры до +100 градусов Цельсия.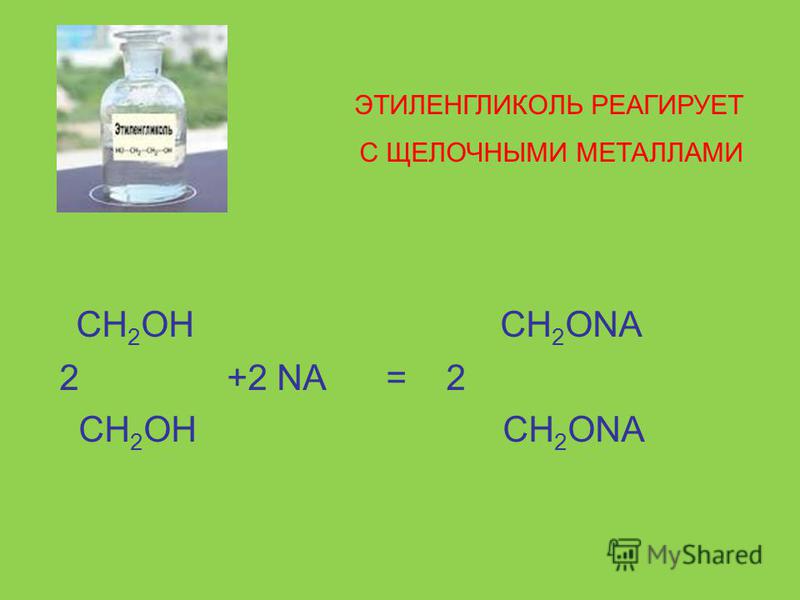 Теплофизические свойства водного раствора глицерина зависят от его концентрации в смеси.
Теплофизические свойства водного раствора глицерина зависят от его концентрации в смеси.
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Динамическая вязкость**, μ | Кинематическая вязкость***, ν | Теплопроводность, λ | Коэффициент температуропроводности, a | Число Прандтля, Pr | Поверхностное натяжение, σ |
| оС | кг/м3 | кДж / (кг • К) | (Н • c/м 2) • 103 | м2/с • 106 | Вт/(м • K) | м2/с • 107 | — | Н/м • 103 |
| 0 | 1273 (1275) | 2,261 | 12070 (12100) | 9466,67 | 0,283 | 0,982 | 96432 | — |
| 10 | 1267 (1269) | 2,320 | 3900 (3950) | 3078,14 | — | 31915 | — | |
| 20 | 1262 (1263) | 2,386 (2,35) | 1410 (1480) | 1111,11 | 0,284 | 0,957 | 11846 | (59,4) |
| 30 | 1255 (1257) | — | 612 (600) | 487,65 | — | 5154 | (59,0) | |
| 40 | 1249 (1251) | (2,45) | 284 (330) | 224,86 | 0,286 | 0,933 | 2827 | (58,5) |
| 50 | (1244) | 2,512 | 182 (180) | — | (0,283) | 0,905 | 1598 | (58,0) |
| 60 | (1238) | (2,56) | 81,3 (102) | 64,68 | — | — | 919 | (57,4) |
| 70 | — | — | 50,6 (59) | — | — | — | — | (56,7) |
| 80 | (1224) | (2,67) | 31,9 (35) | 25,5 | 0,285 | 0,872 | 328 | (55,9) |
| 90 | — | — | 21,3 (21) | — | — | (55,0) | ||
| 100 | (1208) | (2,79) | 14,8 (13) | 15,7 | (0,289) | 0,857 | 125 | (54,2) |
| 110 | 1202 | — | — | — | — | — | — | (53,2) |
| 120 | 1194 (1188) | (2,90) | (5,2) | 4,37 | — | — | — | (52,2) |
| 130 | 1187 | — | — | — | ||||
| 140 | 1180 (1167) | (3,01) | (1,8) | 1,54 | — | — | — | (50,0) |
| 160 | 1164 (1143) | (3,12) | (1,0) | 0,96 | — | — | — | — |
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств глицерина.
Плотность глицерина
⋆ [ кг/м3 ]Теплоёмкость глицерина
⋆ [ Дж/(кг • К) ]Теплопроводность глицерина
⋆ [ Вт/(м • K) ]Кинематическая вязкость глицерина
⋆ [ м2/с ] формула для диапазона температур от 273 до 313 KДинамическая вязкость глицерина
[ Па • c ]Число Прандтля
[ — ]Температуропроводность глицерина
[ м2/с ]⋆ Приближённые формулы получены авторами настоящего сайта.
Размерность величин: температура — К (Кельвин).
Приближённые формулы действительны в диапазоне температур от 273 К до 333 К.
* Табличные подготовлены по материалам справочника «Свойства веществ», а также данным с сайта https://www.
Вязкость указана для концентрации 100%.
Табличные значения кинематической вязкости рассчитаты исходя из имеющихся данных динамической вязкости и плотности.
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт.
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода. |
CH2(OH)-CH2OH + 2K → CH2(OK)-CH2OK + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
Например, этиленгликоль реагирует с бромоводородом. |
CH2(OH)-CH2OH + 2HBr → CH2Br-CH2Br + 2H2O
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль: |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода.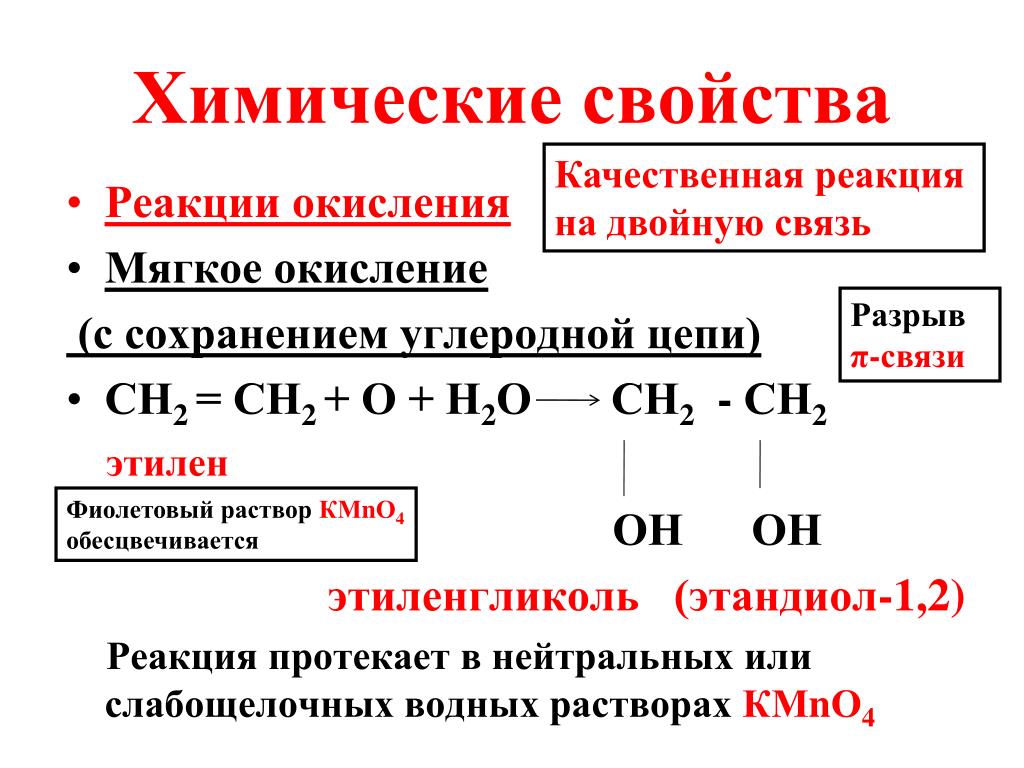 При высокой температуре (180оС) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
При высокой температуре (180оС) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.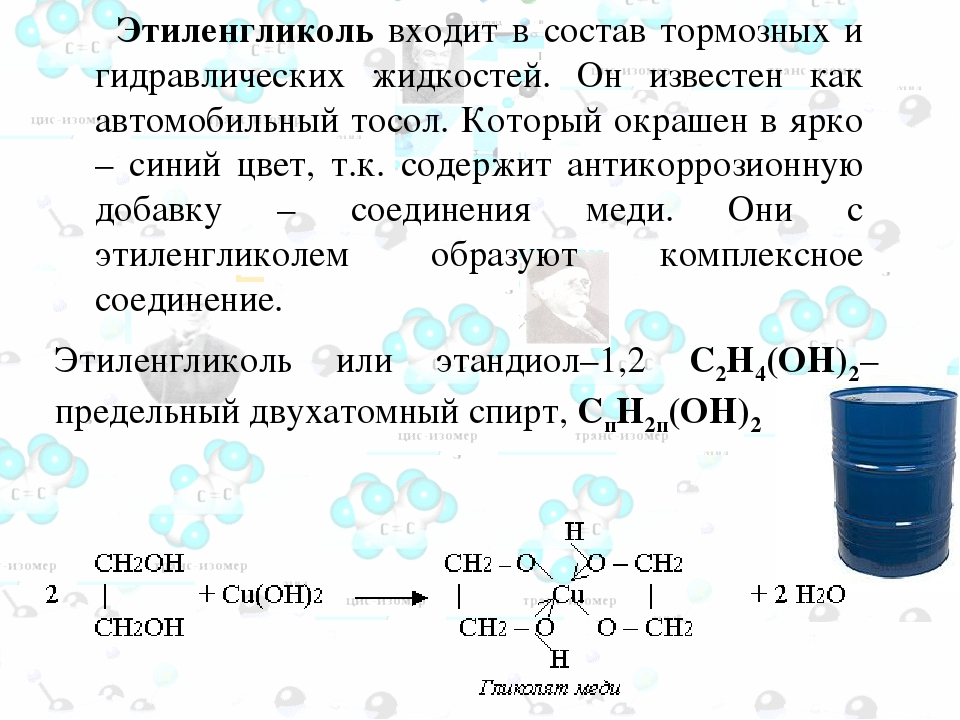 ).
).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
2C2H4(OH)2 + 5O2 = 4CO2 + 6H2O
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
CH2(OH)-CH2OH → CHO-CHO + 2H2
1.
 Щелочной гидролиз дигалогеналканов
Щелочной гидролиз дигалогеналкановПри взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
CH2Cl-CH2Cl + 2NaOH → CH2OH-CH2OH + 2NaCl
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2→ CH2(OH)-CH2OH
3. Гидролиз сложных эфировПри гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
Этиленгликоль, структурная формула, химические, физические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.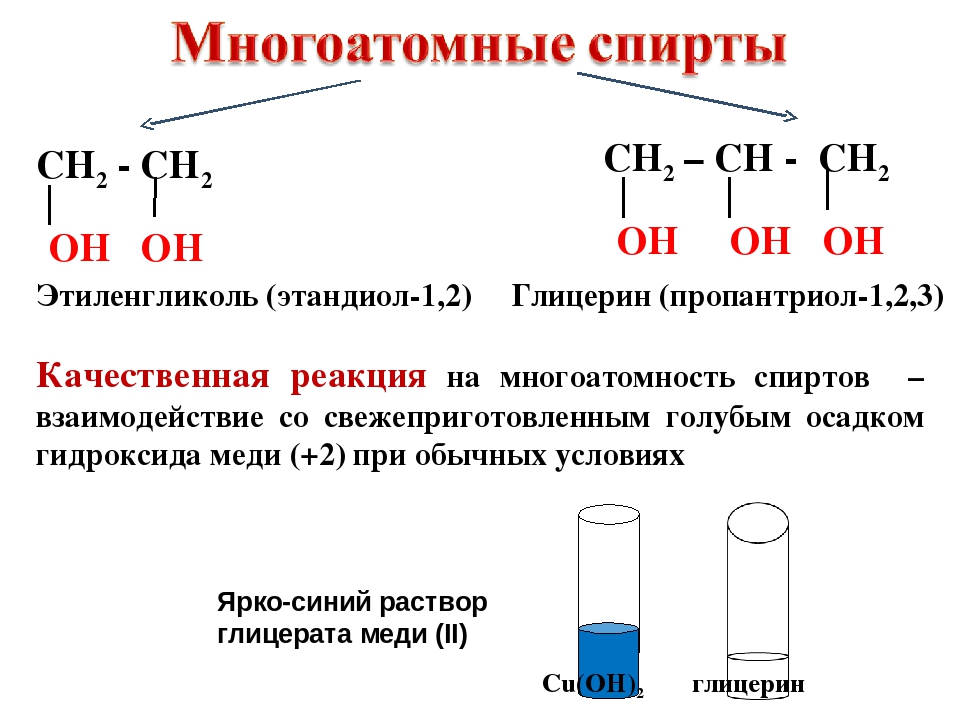
Чтобы получить подробное описание элемента, кликните по его названию.
Этандиол-1,1, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Метоксиметанол, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.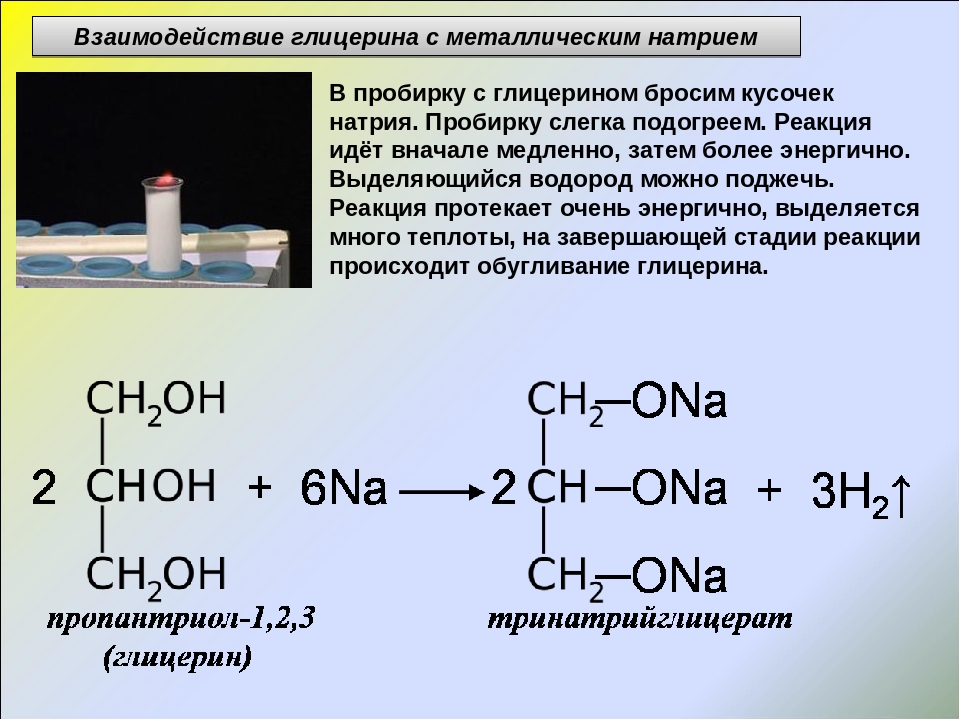
Чтобы получить подробное описание элемента, кликните по его названию.
Этилгидропероксид, структурная формула, свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Жидкий теплоноситель на основе этиленгликоля
Водные растворы на основе этиленгликоля широко используются в системах теплопередачи, где температура теплоносителя может быть ниже 32 o F (0 o C) . Этиленгликоль также обычно используется в системах отопления, которые временно не могут работать (в холодном состоянии) в среде с морозными условиями — например, в автомобилях и машинах с двигателями с водяным охлаждением.
Этиленгликоль — наиболее распространенная антифризная жидкость для стандартных систем отопления и охлаждения.Следует избегать использования этиленгликоля, если есть малейшая вероятность утечки в питьевую воду или системы обработки пищевых продуктов. Вместо этого обычно используются растворы на основе пропиленгликоля.
Удельная теплоемкость, вязкость и удельный вес раствора воды и этиленгликоля значительно зависят от процентного содержания этиленгликоля и температуры жидкости. Свойства настолько сильно отличаются от чистой воды, что системы теплопередачи с этиленгликолем должны быть тщательно рассчитаны для фактической температуры и раствора.
Свойства настолько сильно отличаются от чистой воды, что системы теплопередачи с этиленгликолем должны быть тщательно рассчитаны для фактической температуры и раствора.
Точка замерзания водных растворов на основе этиленгликоля
Точки замерзания водных растворов на основе этиленгликоля при различных температурах указаны ниже
| Точка замерзания | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Раствор этиленгликоля (% по объему ) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 90 | 100 | |
| Температура | ( o F) | 32 | 25.9 | 17,8 | 7,3 | -10,3 | -34,2 | -63 | ≈ -51 | ≈ -22 | 9 |
| ( o C) | 0 | — 3,4 | -7,9 | -13,7 | -23,5 | -36,8 | -52,8 | ≈ -46 | ≈ -30 | -12,8 | |
Этиленгликоль и вода из-за возможного образования слякоти растворы не следует использовать в условиях, близких к точкам замерзания.
Динамическая вязкость водных растворов на основе этиленгликоля
Динамическая вязкость — μ — водных растворов на основе этиленгликоля при различных температурах указаны ниже
| Динамическая вязкость — μ — (сантипуаз ) | ||||||||
|---|---|---|---|---|---|---|---|---|
| Температура | Раствор этиленгликоля (% по объему) | |||||||
| ( o F) | ( o C) | 25 | 30 | 40 | 50 | 60 | 65 | 100 |
| 0 | -17.8 | 1) | 1) | 15 | 22 | 35 | 45 | 310 |
| 40 | 4,4 | 3 | 3,5 | 4,8 | 6,5 | 9 | 10,2 | 48 |
| 80 | 26,7 | 1,5 | 1,7 | 2,2 | 2,8 | 3,8 | 4,5 | 15,5 |
| 120 | 48. 9 9 | 0,9 | 1 | 1,3 | 1,5 | 2 | 2,4 | 7 |
| 160 | 71,1 | 0,65 | 0,7 | 0,8 | 0,95 | 1,3 | 1,5 | 3,8 |
| 200 | 93,3 | 0,48 | 0,5 | 0,6 | 0,7 | 0,88 | 0,98 | 2,4 |
| 240 | 115.6 | 2) | 2) | 2) | 2) | 2) | 2) | 1,8 |
| 280 | 137,8 | 900 2)2) | 2) | 2) | 2) | 2) | 1.2 | |
- 3 ниже точки замерзания выше точки замерзания точка
Примечание! Динамическая вязкость водного раствора на основе этиленгликоля увеличивается по сравнению с динамической вязкостью чистой воды.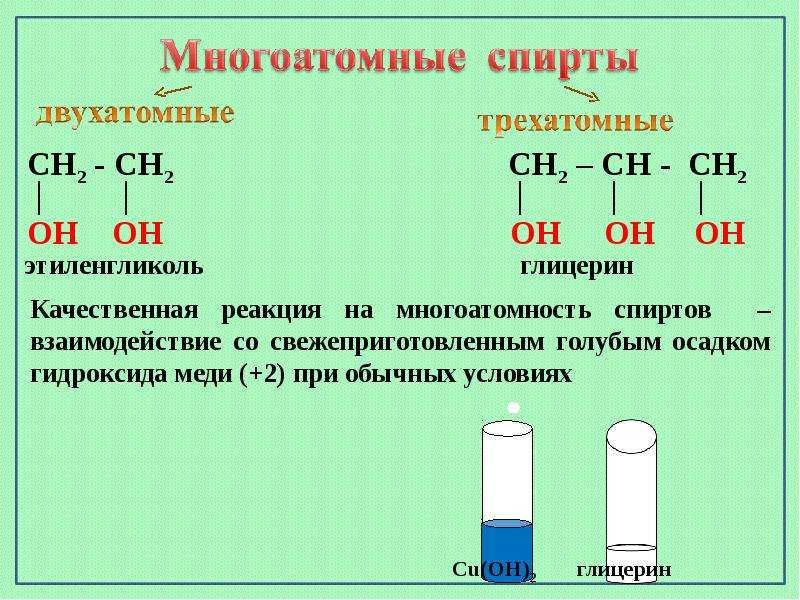 Как следствие, потеря напора (потеря давления) в системе трубопроводов с этиленгликолем на увеличена на по сравнению с чистой водой.
Как следствие, потеря напора (потеря давления) в системе трубопроводов с этиленгликолем на увеличена на по сравнению с чистой водой.
Удельный вес водных растворов на основе этиленгликоля
Удельный вес — SG — водных растворов на основе этиленгликоля при различных температурах указан ниже
| Удельный вес — SG — | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Температура | Раствор этиленгликоля (% по объему) | |||||||||||
| ( o F) | ( o C) | 25 | 30 | 40 | 50 | 60 | 65 | 100 | ||||
| -40 | -40 | 1) | 1) | 1) | 1) | 1.12 | 1,13 | 1) | ||||
| 0 | -17,8 | 1) | 1) | 1,08 | 1,10 | 1,11 | 1,12 | 1,16 | ||||
| 40 | 4,4 | 1,048 | 1,057 | 1,07 | 1,088 | 1,1 | 1,11 | 1,145 | ||||
| 80 | 26,7 | 1. 04 04 | 1.048 | 1.06 | 1.077 | 1.09 | 1.095 | 1.13 | ||||
| 120 | 48.9 | 1.03 | 1.038 | 1.05 | 1.064 | 1.077 | 1.082 | 1.115 | 1.077 | 1.082 | 1.115 | |
| 160 | 71,1 | 1,018 | 1,025 | 1,038 | 1,05 | 1,062 | 1,068 | 1,1 | ||||
| 200 | 93.3 | 1.005 | 1.013 | 1.026 | 1.038 | 1.049 | 1.054 | 1.084 | ||||
| 240 | 115,6 | 2) | 2) | 54 2) 2) | 2) | 2) | 1.067 | |||||
| 280 | 137,8 | 2) | 2) | 2) | 2) | 2) | 2) | 1. 05 05 | ||||
- ниже точки замерзания
- выше точки кипения
Примечание! Удельный вес водных растворов на основе этиленгликоля увеличен по сравнению с удельным весом чистой воды.
Плотность водных растворов на основе этиленгликоля
Поверните экран, чтобы увидеть всю таблицу.
Пример — Объем расширения в системе обогрева с этиленгликолем
Система обогрева с объемом жидкости 0.8 м 3 защищен от замерзания 50% (по массе, массовая доля 0,5) этиленгликоль. Температура установки системы составляет 0 o C , а максимальная рабочая температура среды составляет 80 o C .
Из приведенной выше таблицы видно, что плотность раствора при температуре установки может достигать 1090 кг / м 3 — а средняя плотность при рабочей температуре может достигать 1042 кг / м 3 .
Массу жидкости при установке можно рассчитать как
м inst = ρ inst V inst (1)
= (1090 кг / м 3 ) (0,8 м 3 )
= 872 кг
где
м inst = масса жидкости при установке (кг)
ρ inst = плотность при установке (кг / м 3 )
V inst = объем жидкости при установке (м 3 )
Масса жидкости в системе во время работы будет такой же, как масса в системе во время установки
м inst = м op (2)
= ρ op V op 9002 6
где
м op = масса жидкости при работе (кг)
ρ op = плотность при работе (кг / м 3 ) 09 V 906 op = объем жидкости при работе (м 3 ) (2) можно изменить для расчета рабочего объема жидкости как V op = м inst / ρ op (2b) = (872 кг) / ( 1042 кг / м 3 ) = 0. Требуемый объем расширения, чтобы избежать давления, можно рассчитать как ΔV = V op — V inst (3) = (0,837 м 3 ) — (0,8 м 3 ) = 0,037 м 3 = 37 литров где ΔV = объем расширения (м 69 ) Объем расширения можно рассчитать как ΔV = ( ρ inst / ρ op -1 ) V inst26 9 Теплота водных растворов на основе этиленгликоля Удельная теплоемкость — c p — водных растворов на основе этиленгликоля при различных t температуры указаны ниже Поверните экран на всю таблицу. Примечание! Удельная теплоемкость водных растворов на основе этиленгликоля на меньше, чем на , чем удельная теплоемкость чистой воды. В растворе 50% с рабочими температурами выше 36 o F удельная теплоемкость уменьшается примерно на 20% . Сниженная теплоемкость должна быть компенсирована циркуляцией большего количества жидкости. Примечание! Плотность этиленгликоля выше, чем у воды — проверьте приведенную выше таблицу удельного веса (SG), чтобы снизить чистое воздействие на теплопередающую способность. Пример — удельная теплоемкость водного раствора этиленгликоля 50% / 50% равна 0.815 при 80 o F (26,7 o ° C). Удельный вес при тех же условиях составляет 1,077. Чистое воздействие можно оценить как 0,815 * 1,077 = 0,877. Автомобильные антифризы не следует использовать в системах отопления, вентиляции и кондиционирования воздуха, поскольку они содержат силикаты, которые могут вызвать загрязнение. Примечание! Для растворов этиленгликоля следует использовать дистиллированную или деионизированную воду. Городскую воду можно обрабатывать хлором, который вызывает коррозию. Не следует использовать системы автоматической подпитки, так как утечка приведет к загрязнению окружающей среды и ослаблению защиты системы от замерзания. Для полной таблицы с точками кипения — поверните экран! Увеличение циркулирующего потока для 50% растворов этиленгликоля по сравнению с чистой водой указаны в таблице ниже Поправка на перепад давления и комбинированная поправка на перепад давления и увеличение расхода для 50% раствора этиленгликоля по сравнению с чистой водой указаны в таблице ниже Для низкотемпературных гидравлических систем, систем, в которых чиллеры и кондиционеры расположены на открытом воздухе, или В другом оборудовании, используемом в низкотемпературных процессах, критически важным ингредиентом является некоторая форма гликоля.Он снижает температуру замерзания жидкости, обеспечивая работу при более низких температурах и предотвращая замерзание. В принципе, если есть риск того, что ваше оборудование, содержащее жидкость, подвергнется воздействию отрицательных температур, ему потребуется какая-то форма гликоля. Для этой функции используются два основных типа гликоля: этилен и пропилен. Что такое этиленгликоль? Этиленгликоль (CH2OH₂), также известный как 1,2-этандиол, представляет собой органическое соединение на спиртовой основе, часто используемое в качестве антифриза в оборудовании HVAC и системах транспортных средств, среди прочего.Это бесцветная вязкая жидкость без запаха, обладающая сладким вкусом. В чистом виде этиленгликоль замерзает при температуре около -10 ° F, но при смешивании с водой он может оставаться жидким при гораздо более низких температурах. Например, смесь, состоящая из 40% воды и 60% гликоля, может выдерживать температуры, близкие к -50 ° F, перед замерзанием. [1] Для гликолей, используемых в качестве теплоносителя, вязкость — сопротивление жидкости потоку — является критическим свойством, влияющим на скорость потока, потери на трение и, в конечном итоге, на тепловые характеристики. Нравится то, что вы читаете? Подпишитесь на наш блог и никогда не пропустите ни одного поста! Когда следует использовать этиленгликоль? Между этиленом и пропиленгликолем этиленгликоль является более теплопроводным из двух (см. Таблицу ниже).Следовательно, этиленгликоль — хороший выбор для приложений, в которых тепловые характеристики являются наивысшим приоритетом. По сути, если ни одно из обстоятельств, описанных в следующем разделе, не описывает ваше приложение, этиленгликоль, вероятно, будет лучшим вариантом. Когда нельзя Я использую этиленгликоль? Этиленгликоль токсичен для человека, вызывая ряд физиологических проблем при проглатывании, включая смерть (Центры по контролю за заболеваниями оценивают летальную дозу от 1400 до 1600 мг / кг).В результате этиленгликоль не следует использовать в приложениях, в которых возможно загрязнение питьевой воды. Его также не следует использовать для систем отопления или охлаждения на предприятиях, таких как предприятия пищевой промышленности, или на других предприятиях, производящих продукты для потребления. Причина этого двоякая. Этиленгликоль вреден для наземных и водных животных, и при попадании в водные пути его биоразложение занимает от 10 до 30 дней. Гликоли биоразлагаются посредством аэробного биоразложения, во время которого разложение гликолей запускается бактериями, которым для выполнения этой функции требуется кислород.Это действие снижает уровень кислорода в затронутых водных путях, что может иметь разрушительные последствия, если количество гликоля и скорость биоразложения достаточно велики. Что такое пропиленгликоль? Пропиленгликоль (C₃H₈O₂), также называемый пропан-1,2-диолом, представляет собой синтетическую жидкость, используемую для множества целей в десятках отраслей промышленности. Это вязкая, бесцветная жидкость почти без запаха, обладающая слегка сладковатым вкусом. Как и этиленгликоль, пропиленгликоль комбинируется с водой в различных концентрациях для снижения температуры замерзания рабочей жидкости в системах теплопередачи. Температура эвтектики или минимально возможная температура замерзания, достижимая при любом соотношении двух веществ (пропиленгликоль + вода), составляет -76 ° F при концентрации 60% пропиленгликоля и 40% воды. Однако в коммерческих продуктах это соотношение обычно меняется на противоположное: 40% пропиленгликоля и 60% воды, температура замерзания которых ближе к -50 ° F [2]. Когда мне следует использовать пропиленгликоль? Ответ на этот вопрос также отвечает на вопрос «когда не следует использовать пропиленгликоль?» также. Очень мало, если вообще есть, случаев, когда пропиленгликоль был бы выбран из-за его тепловых характеристик. Он просто менее эффективен, чем этиленгликоль, по своему назначению. Но, учитывая токсичность этиленгликоля, существует несколько приложений, для которых необходимо использовать пропиленгликоль, например, те, которые мы рассмотрели ранее в этом посте, а именно производство продуктов питания, приложения, в которых возможно загрязнение воды, и системы HVAC на объектах такого типа. Пропиленгликоль считается относительно безопасным для человека. Это распространенный ингредиент в различных косметических продуктах, фармацевтических препаратах и пищевых добавках непрямого действия. Хотя пропиленгликоль менее токсичен, чем этиленгликоль, он может представлять некоторые проблемы для окружающей среды. Пропилен, как и этиленгликоль, расщепляется аэробными средствами, но если для биоразложения этилена требуется примерно 10–30 дней, то для пропиленгликоля это происходит за 20–30 дней или более. Все еще не уверены, какой тип гликоля лучше всего подходит для вашей области применения? Позвоните компании Super Radiator Coils, и давайте поговорим. Не оставайтесь незамеченными, когда дело касается теплопередачи. Чтобы быть в курсе самых разных тем по этой теме, подпишитесь на The Super Blog, наш технический блог, Doctor’s Orders и подпишитесь на нас в LinkedIn, Twitter и YouTube. [1] Зигфрид Ребсдат; Дитер Майер. «Этиленгликоль». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH [2] «Свойства некоторых частных решений» (PDF). Портал ДМТ. Проверено 22 сентября 2020 г. Чистый этиленгликоль имеет очень плохую электропроводность и почти изолирует. В лаборатории было измерено, что удельное сопротивление чистого этиленгликоля примерно в 40 раз выше, чем у воды типа II по ASTM [27]. В растворе этиленгликоля коррозионные повреждения магния локализованы. Язвенная коррозия хорошо видна на поверхности [27], а окружающая область, где она не подверглась коррозии, относительно блестящая.Яма представляет собой активный анод, а окружающая его блестящая область представляет собой катод, защищенный от коррозии в результате точечной коррозии. На рисунке 11.5 схематично показана локальная питтинговая коррозия и соответствующая эквивалентная схема для магния в растворе этиленгликоля. 11.5. Модель питтинга магния в растворе этиленгликоля и соответствующая схема замещения. Локальное коррозионное повреждение означает, что скорость точечной коррозии ограничивается сопротивлением раствора в яме, и, таким образом, удельное сопротивление раствора может значительно влиять на коррозионную стойкость или сопротивление поляризации магния в растворе этиленгликоля. В загрязненном растворе этиленгликоля сопротивление раствора снижается с увеличением концентрации каждого загрязняющего вещества NaCl, Na 2 SO 4 или NaHCO 3 . Уменьшение поляризационного сопротивления магния можно объяснить повышенным общим содержанием ионов в растворе. При низком содержании загрязняющих веществ проводимость раствора пропорциональна концентрации электролитов.Снижение стойкости к растворам особенно заметно при увеличении концентрации NaCl. Это объясняет наиболее пагубное влияние NaCl на коррозионные характеристики магния в загрязненном растворе этиленгликоля. Снижение стойкости раствора, вызванное загрязнителями, также может объяснить небольшое увеличение скорости коррозии магния в этиленгликоле при добавлении Mg (OH) 2 и Mg (NO 3 ) 2 (рис. Помимо стойкости к раствору, наиболее фундаментальным объяснением коррозионного поведения магния в этиленгликоле может служить граница раздела магний / этиленгликоль.Как и большинство других органических веществ, этиленгликоль может адсорбироваться на поверхности электрода. Емкость C d является хорошим показателем адсорбции этиленгликоля на поверхности магния. Было измерено [27], что емкость уменьшается с увеличением концентрации этиленгликоля. Уменьшение емкости интерфейса может быть вызвано тем, что вода с высокой диэлектрической проницаемостью на границе раздела заменяется более длинными молекулами диэлектрика. Молекула этиленгликоля больше и менее полярна, чем вода.Его адсорбция на поверхности магния, безусловно, может привести к более низкому значению C d . Когда концентрация этиленгликоля увеличивается, больше этиленгликоля будет адсорбироваться на поверхности, что приведет к более низкому значению C d . В загрязненном растворе NaCl, Na 2 SO 4 и NaHCO 3 меньше по размеру, чем этиленгликоль. Увеличение емкости должно быть связано с заменой этиленгликоля на поверхности магния загрязняющими веществами. SO 4 2 — и HCO 3 — могут адсорбироваться на поверхности магния сильнее (легче), чем Cl — . Дополнительный адсорбированный этиленгликоль можно заменить на Na 2 SO 4 или NaHCO 3 , и в результате этого обмена получается более высокая поверхностная емкость, чем от NaCl при той же весовой / объемной концентрации этих загрязняющих веществ.Тем не менее хорошо известно, что хлориды намного более агрессивны, чем сульфаты и карбонаты. Более сильная адсорбция Na 2 SO 4 или NaHCO 3 , чем хлорид, означает, что если ионы Na 2 SO 4 или NaHCO 3 добавляются в хлоридсодержащий раствор этиленгликоля, адсорбированные ионы Cl — на поверхности магния будут заменены сульфатом или карбонатом.Поскольку сульфат или карбонат гораздо менее агрессивны для магния, чем хлорид, замена адсорбированных хлоридов сульфатами или карбонатами фактически пассивирует активные центры на поверхности магния. Следовательно, растворение магния замедляется. Следовательно, в хлоридсодержащем растворе Na 2 SO 4 или NaHCO 3 будут играть двойную роль. Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Существует множество причин, по которым cookie не может быть установлен правильно. Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт. Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины: Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня. Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется. Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать. Гликоль — это органическое химическое соединение, принадлежащее к семейству спиртов. В молекуле гликоля (другое название диола) он содержит две гидроксильные группы, присоединенные к разным атомам углерода. Гликоли относятся к спиртовой группе химических веществ. Хотя и пропиленгликоль, и этиленгликоль имеют большое количество применений в различных отраслях промышленности, включая косметику и консерванты (пропиленгликоль), а также в производстве смол, чернил и полиэтилентерефталата (этиленгликоль) имеют общее применение. в смесях антифриза и охлаждающей жидкости. Антифриз обычно представляет собой смесь дистиллированной воды с основным продуктом — этиленгликолем или пропиленгликолем. В некоторые формулы также иногда добавляют специальный ингибитор для защиты металлов системы от коррозии. Антифриз выполняет двойную функцию — снижает температуру замерзания жидкости в системе охлаждения, а также повышает температуру кипения воды. Благодаря этому раствор антифриза помогает поддерживать бесперебойную работу систем охлаждения и очищать их от образования льда в холодных погодных условиях, а также предотвращает любые проблемы с перегревом. Основное различие между пропиленгликолем и этиленом — уровень токсичности. Пропиленгликоль имеет очень низкую токсичность, поэтому он также содержится в косметике и средствах личной гигиены, тогда как этиленгликоль ядовит, и с ним необходимо обращаться осторожно, чтобы ограничить любое воздействие на человека или животных. Так почему бы просто не использовать пропиленгликоль? Использование этиленгликоля по сравнению с пропиленгликолем дает ряд преимуществ, особенно в системах с замкнутым контуром, где риск контакта с пищевыми продуктами минимален.Например, понижение точки замерзания намного эффективнее при использовании этиленгликоля, поэтому для поддержания той же точки замерзания, что и этилен, потребуется больше пропиленгликоля. Кроме того, из-за более низкой вязкости этиленгликоля он обладает прекрасными свойствами теплопередачи. Использование пропилена или этиленгликоля зависит от области применения и риска случайного контакта с пищевыми продуктами, питьевой водой или проглатыванием человеком. Например, пропиленгликоль в самолетах используется как для удаления льда, так и для удаления загрязнений с самолета, а также используется зимой и в периоды снегопада для активного предотвращения накопления снега и льда.Он также присутствует в ряде антифризов для супермаркетов. В то время как этиленгликоль будет использоваться в закрытых системах и в контролируемых промышленных приложениях. Monarch Chemicals поставляет этиленгликоль и пропиленгликоль, а также линейку ингибированных гликолей Moncool. Для получения дополнительной информации о выборе подходящего гликоля для вашего применения или рецептуры свяжитесь с нами. Значения плотности обоих наборов наножидкостей, A-TiO 2 / EG и R-TiO 2 / EG, при массовой доле до 5 мас.% измерены экспериментально при давлении до 45 МПа в широком диапазоне температур от 278,15 до 363,15 К по восьми изотермам. В таблице 2 приведены экспериментальные данные плотности для обеих наножидкостей. Значения плотности варьируются от 1,0627 г см −3 для чистого ЭГ при 0,1 МПа и 363,15 К до 1,1800 г см −3 для наножидкостей A-TiO 2 / EG и 1,1838 г см −3 для наножидкостей R-TiO 2 / EG при 5 мас.%, p = 45 МПа и T = 278,15 К.При эквивалентной температуре, давлении и концентрации значения плотности A-TiO 2 / EG ниже, чем у R-TiO 2 / EG, за исключением образца 1 мас.%, Для которого они согласуются в пределах экспериментальная неопределенность. Значения плотности увеличиваются с концентрацией наночастиц, как и ожидалось, как показано на рисунке 3a, где показаны приращения по отношению к эталонному значению базовой жидкости при различных концентрациях, с более высокими приращениями также для нанокристаллической структуры рутила, достигая значений 3.8%. Мы обнаружили, что эти приращения с концентрацией почти не зависят от температуры и давления. Для заданной концентрации данные плотности показывают зависимости давления и температуры, аналогичные базовой жидкости, увеличиваясь с давлением и уменьшаясь с температурой. Среднее процентное приращение плотности увеличивается с диапазоном давления от 1,5% при самой низкой температуре до 2% при самой высокой температуре. С другой стороны, на Рисунке 3b собраны средние процентные уменьшения плотности с температурой при различных давлениях, показывающие уменьшение от 5% до 5.4%. Эти колебания температуры очень похожи как для нанокристаллических структур, так и для базовой жидкости, что можно увидеть на этом рисунке. Изменение средней плотности в зависимости от концентрации наночастиц и давления. ( a ) Увеличение плотности по отношению к базовой жидкости (100 × ( ρ nf — ρ 0 ) / ρ 0 ) в зависимости от концентрации ( мас.%) для обеих нанокристаллических структур. ( b ) Уменьшение плотности в зависимости от температуры (−100 × (Δ ρ ) / ρ ) от давления ( p ) для базовой жидкости и обеих нанокристаллических структур. Крестик, базовая жидкость; алмаз, A-TiO 2 / EG; треугольник, R-TiO 2 / EG. С целью получения обобщенной корреляции температуры и давления объемного поведения измеряемой базовой жидкости и наножидкостей, удельные объемы ( v = 1 / ρ ), используя следующее выражение [34], были скорректированы до экспериментальные данные: vT, p = vT, pref · 1 − p − prefBT, p, (1) , где эталонное давление, p ref , было принято 0.1 МПа. Зависимость удельного объема при этом давлении описывалась следующим выражением [35, 36]. vT, pref = vrefTref, pref × ea.θ + b⋅θ2withθ = T − Tref, (2) , где a , b и v ref ( T ref , p ref ) — настраиваемые параметры, v ref (89 T , p ref ) — удельный объем при эталонной температуре T ref = 278.15 К и давление p ref = 0,1 МПа. Эти коэффициенты, значения которых приведены в таблице 3, были подобраны для базовой жидкости и различных наножидкостей со стандартными отклонениями, меньшими или равными 2,8 см 3 г -1 . Модуль объемной упругости B ( T , p ) был скорректирован как функция давления и температуры с помощью следующего полинома: BT, p = Bpref, Tref + c⋅θ + d⋅θ2 + e⋅Δp + f⋅Δp2сΔp = p − pref. (3) Значения B ( p ref , T ref ), c , d , e и f были определены путем подгонки уравнения 1 ко всем экспериментальным данные при давлениях, отличных от p ref методом наименьших квадратов с использованием алгоритма типа Марквардта-Левенберга.Для базовой жидкости и всех исследованных наножидкостей стандартные отклонения, полученные с помощью этой корреляции, меньше или равны 1,4 × 10 −4 см 3 г −1 , а коэффициенты приведены в таблице 3. Хотя вязкость, теплоемкость и теплопроводность являются основными параметрами, участвующими в расчете скорости теплопередачи наножидкости, точное определение плотности также важно, потому что, как отмечалось выше, эти свойства могут сильно отличаться от свойств исходная чистая жидкость, и это может привести к ошибочному массовому балансу.Как мы уже отмечали, значительные изменения плотности могут быть достигнуты при подробном анализе температуры, давления, концентрации или типа нанокристаллической структуры. Чтобы проверить некоторые общепринятые предположения [3, 20], мы определили идеальную плотность наножидкости из плотностей наночастиц и базовой жидкости согласно [25]: ρnf = ϕ⋅ρ + 1 − φ · ρ0, (4) где ϕ — объемная доля наночастиц, а индексы np, 0 и nf относятся к наночастицам, базовой жидкости и наножидкости соответственно.Плотность анатаза и оксида титана рутила составляет соответственно 3,830 и 4,240 г / см −3 [37]. Чтобы оценить точность этой оценки, наши экспериментальные значения сравнивали с предсказанными с помощью этого уравнения. Было обнаружено, что это уравнение переоценивает плотность наножидкостей, изученных в данной работе, с отклонениями, которые могут достигать 0,5% для A-TiO 2 / EG и 0,3% для R-TiO 2 / EG при самых высоких концентрациях и температуры, как показано на рисунке 4. Отклонения в процентах между экспериментальной и прогнозируемой плотностями. Отклонения между экспериментальными данными плотности ( ρ exp ) и прогнозируемыми значениями ( ρ pred ) по уравнению 4 в зависимости от массовой концентрации (мас.%) Для ( a ) A-TiO 2 / EG и ( b ) R-TiO 2 / EG наножидкости. Изобарическое тепловое расширение, α p , изотермическая сжимаемость, κ T , коэффициенты могут быть определены из корреляций удельного объема с использованием соответствующих термодинамических определений в соответствии со следующими выражениями: αp = 1v · ∂vT, p∂Tp = ∂vT, pref∂TvT, pref + ∂BT, p∂Tp · ΔpBT, p · BT, p − Δp, (5) κT = −1v · ∂vT, p∂pT = BT, p − ∂BT, p∂pT · ΔpBT, p · BT, p − Δp. (6) В таблице 2 значения, рассчитанные для α p и κ T приведены для некоторых температур и давлений для базовой жидкости (EG) и обеих наножидкостей при двух различных концентрациях (1,75 и 5,00 мас.%). Оценочные неопределенности для α p и κ T составляют 4% и 2% соответственно.Модель α p Значения как для базовой жидкости, так и для наножидкостей R-TiO 2 / EG и A-TiO 2 / EG уменьшаются при повышении давления (до 9,8% для базовой жидкости) и увеличиваются с увеличением температуры (до 6,6% для базовая жидкость). Что касается концентрационной зависимости, во-первых, мы обнаружили, что α p Значения для наножидкостей очень похожи или ниже, чем у EG, достигая уменьшения до 1.0% и 1,9% для наножидкостей A-TiO 2 / EG и R-TiO 2 / EG соответственно. Эти результаты противоположны результатам, полученным ранее Nayak et al. [8, 9], сообщая о значительном улучшении этого свойства по сравнению с базовой жидкостью для наножидкостей на водной основе Al 2 O 3 , CuO, SiO 2 и TiO 2 . Следует отметить, что Nayak et al. определили изобарическое тепловое расширение путем измерения изменения объема в зависимости от температуры для образцов в стеклянной колбе с длинной калиброванной ножкой.Следовательно, дальнейшие исследования этого свойства все еще необходимы для наножидкостей на основе ЭГ или воды. С другой стороны, κ T Значения исследованных образцов не имеют явной зависимости от концентрации или нанокристаллической структуры (либо эти различия находятся в пределах неопределенности). Модель κ T Значения уменьшаются при повышении давления и увеличиваются с повышением температуры вдоль изобар как для базовой жидкости, так и для образцов наножидкости, как можно увидеть в таблице 2. Чтобы сравнить объемное поведение наножидкостей с поведением идеальной жидкости, были рассчитаны избыточные молярные объемы, VmE [10, 38]. На рис. 5 показано увеличение объема как для A-TiO 2 / EG, так и для R-TiO 2 / EG. Такое поведение также было обнаружено для других чистых наножидкостей на основе ЭГ, и оно противоречит поведению наножидкостей, в которых в качестве базовой жидкости используется вода или ЭГ + вода [28]. Избыточные молярные объемы для A-TiO 2 / EG немного увеличиваются с концентрацией наночастиц от 0.03 до 0,11 см 3 моль -1 , что соответствует изменению молярного объема от 3,3% до 14,3%. Что касается R-TiO 2 / EG, его поведение ближе к идеальному, и он почти не зависит от концентрации с максимальным изменением объема 4,6%. Существенных зависимостей от температуры или давления для этого свойства не обнаружено. Избыточные мольные объемы наножидкостей VmE . Зависимость молярных избыточных объемов от мольной доли для различных наножидкостей EG при 303.15 К и 20 МПа. Закрашенный кружок, A-TiO 2 / EG; закрашенный треугольник, R-TiO 2 / EG; пустой треугольник, Fe 3 O 4 / EG [38]; пустой алмаз, Fe 2 O 3 / EG [38]; пустой кружок, (48 нм ZnO) / EG [39]; пустой квадрат, (4,6 нм ZnO) / EG [39]. Как уже указывалось, в литературе можно найти лишь ограниченное количество исследований реологического поведения наножидкостей, и есть несоответствия, такие как ньютоновское и неньютоновское поведение, описанные для одной и той же наножидкости, а также расхождения. во влиянии температуры, размера и формы частиц, а также высоких значений сдвиговой вязкости [40–44].В этом контексте ключевой проблемой является получение структурной информации о наножидкости, и одним из возможных методов является подробный реологический анализ [45]. В данной работе было проведено два типа исследований. Вязкость как функция скорости сдвига, так называемая кривая потока, была определена для обеих наножидкостей при 303,15 К и пяти различных массовых концентрациях (5, 10, 15, 20 и 25 мас.%). Приложенные крутящие моменты начинаются с 0,1 мкНм, охватывая диапазон скоростей сдвига от 0,1 до 1000 с -1 .На рис. 6а, б показаны эти кривые течения для обеих наножидкостей при разных концентрациях. В отличие от базовой жидкости, оба набора наножидкостей демонстрируют явное истончение при сдвиге (псевдопластическое) неньютоновское поведение. В области самой низкой скорости сдвига ньютоновские плато легко идентифицируются по мере увеличения концентрации. Это неньютоновское поведение противоречит тому, о чем ранее сообщали Chen et al. [14], в которых изучались наножидкости на основе ЭГ, содержащие от 0,5 до 8,0 мас.% Сферических наночастиц TiO 2 . Chen et al.[14] подтвердили, что ньютоновское поведение обнаруживается при скорости сдвига выше 0,05 с -1 . Следует учитывать, что наши результаты вязкости для ньютоновской ЭГ согласуются с результатами Чена и др. [14] в пределах среднего отклонения 1,5% [32]. Разногласия, обнаруженные в литературе по реологическим исследованиям, указывают на то, что конкретные свойства наночастиц, такие как форма, структура и размер, а также взаимодействие между базовой жидкостью и наночастицами, могут играть существенную роль в определении реологического поведения наножидкостей.Однако в этом случае основные причины различного реологического поведения наножидкостей TiO 2 / EG можно отнести к следующему: (1) диапазон концентраций наночастиц, изученный Chen et al. [14] (<8 мас.%) Ниже, чем анализируемые в этой работе (<25 мас.%), (2) диапазон напряжения сдвига, изученный в этой работе, охватывает более широкую область, и именно здесь происходит разжижение при сдвиге. (3) минимальная скорость сдвига, которую может достичь оборудование, имеет решающее значение для определения первого ньютоновского плато, особенно при низкой концентрации наночастиц, и, наконец, (4) различная стабильность и агрегация частиц влияют на условия потока, поскольку эффективная массовая концентрация может быть выше реальной твердой массы. Вязкость ( η ) в зависимости от скорости сдвига ( γ˙ ) EG / TiO 2 наножидкости при различных концентрациях. Кривые расхода для ( a ) A-TiO 2 / EG и ( b ) R-TiO 2 / EG при 303,15 K и различных массовых концентрациях: крестик , EG; линия, 5 вес.%; круг, 10 мас.%; квадрат, 15 мас.%; алмаз, 20 мас.%; треугольник, 25 мас.%. ( c ) Индекс поведения потока ( n ) в зависимости от объемной доли (ϕ) для A-TiO 2 / EG (закрашенный алмаз) и R-TiO 2 / EG (пустой ромб) при 303,15 К. Модель Оствальда-де Ваэля (степенной закон) использовалась для описания экспериментальных данных сдвиговой динамической вязкости η как функции скорости сдвига γ в области утонения сдвига для каждой концентрации оба набора наножидкостей, используя следующее выражение [46–48]: , где регулируемые параметры K и n являются коэффициентом консистенции потока и показателем поведения потока, соответственно.Для всех исследованных образцов наножидкостей получены хорошие корректировки, достигающие процентного отклонения сдвиговой динамической вязкости около 3%. При той же массовой концентрации значения индекса текучести для наножидкостей R-TiO 2 / EG выше, чем для A-TiO 2 / EG, как показано на рисунке 6c. Эти значения n находятся в диапазоне от 0,27 до 0,72 для A-TiO 2 / EG и от 0,33 до 0,83 для R-TiO 2 / EG, уменьшаясь почти экспоненциально при увеличении объемной доли, что свидетельствует о том, что разжижение при сдвиге поведение более заметно при увеличении концентрации наночастиц.Значения n аналогичны значениям, обычно получаемым для обычных термопластов [49]. Следует также отметить, что, хотя эта модель предлагает простую аппроксимацию поведения истончения при сдвиге, она не предсказывает верхние или нижние ньютоновские плато [47]. В качестве дополнительного теста влияние температуры на кривые потока было изучено для максимальной массовой концентрации (25 мас.%) Для обеих наножидкостей в диапазоне от 283,15 до 323,15 К, как показано на рис. 7a, b, соответственно.На этих кривых течения мы можем наблюдать уменьшение вязкости при повышении температуры, как обнаружили Чен и др. [14] в своем исследовании между 293,15 и 333,15 К. Тем не менее, сдвиговые вязкости, представленные в этой работе, показывают температурную зависимость, очень сильно влияющую на по значению скорости сдвига. Более того, мы можем наблюдать, что вязкость при сдвиге практически не зависит от температуры при скорости сдвига около 10 с -1 как для наножидкостей A-TiO 2 / EG, так и для R-TiO 2 / EG, что не является корпус при высокой или низкой скорости сдвига.С другой стороны, при той же концентрации и температуре наножидкости A-TiO 2 / EG обладают более высокой вязкостью сдвига, чем наножидкости R-TiO 2 / EG для всех скоростей сдвига. Эти различия вязкости увеличиваются с увеличением концентрации. Применяя модель Оствальда-де Ваэля к этим кривым потока при различных температурах, мы также получили хорошие результаты, обнаружив, что значения n увеличиваются с температурой. Это может быть результатом температурного воздействия на лучшую дисперсию наночастиц.Аналогичные увеличения индекса поведения потока также были определены ранее [50, 51]. Вязкость ( η ) в зависимости от скорости сдвига ( γ˙ ) EG / TiO 2 наножидкостей при разных температурах. Кривые расхода для ( a ) A-TiO 2 / EG и ( b ) R-TiO 2 / EG при 25 мас.% массовая концентрация и при разных температурах: квадрат 283,15 К; круг, 293,15 К; треугольник, 303,15 К; алмаз, 313,15 К; крестик, 323,15 К. ( c ) Энергия активации потока жидкости ( E a ) от скорости сдвига для наножидкостей A-TiO 2 / EG (заполненный алмаз) и R-TiO 2 / EG (пустой алмаз) 25 мас.%. Влияние температуры T на вязкость при каждой скорости сдвига можно выразить уравнением типа Аррениуса [52, 53]: , где R — универсальная газовая постоянная, а A и E a — это параметры подгонки предэкспоненциального фактора и энергии активации для потока жидкости, соответственно.Это уравнение хорошо описывает температурную зависимость сдвиговой вязкости исследуемых наножидкостей. На рисунке 7c показано полученное значение E a Значения в зависимости от скорости сдвига для наножидкостей A-TiO 2 / EG и R-TiO 2 / EG с концентрацией 25 мас.%. Принято считать, что выше E a Значения указывают на более быстрое изменение вязкости в зависимости от температуры и высокотемпературную зависимость вязкости [50].Таким образом, нижний E a Значения , найденные для A-TiO 2 / EG, указывают на меньшее влияние температуры на вязкость для этой наножидкости. Более того, при скоростях сдвига около 6 с -1 для A-TiO 2 / EG и около 8 с -1 для R-TiO 2 / EG был обнаружен минимум энергии активации, поскольку можно наблюдать на рисунке 7c. Значения, полученные здесь для A-TiO 2 / EG и R-TiO 2 / EG, аналогичны значениям, полученным Abdelhalim et al.[54] для наночастиц золота в водном растворе. Кроме того, для A-TiO 2 / EG были проведены линейные вязкоупругие колебательные эксперименты с целью изучения их механических свойств при колебательном сдвиге с малой амплитудой. Сила этих испытаний состоит в том, что напряжение можно разделить на два члена и определить модуль упругости или динамический модуль упругости. Затем можно установить, ведет ли наножидкость как основная жидкость без агломератов или, альтернативно, как твердое тело с определенным уровнем агломератов из-за увеличения взаимодействий и столкновений между частицами, которые приводят к образованию геля [55].Во-первых, с целью определения области линейной вязкоупругости, были проведены испытания на развертку деформации (для деформаций от 0,01% до 1000%) при 10 рад / с -1 (см. Рис. 8a, b). Меньшие амплитуды деформации не учитывались из-за условий оборудования, так как форма волны деформации не была синусоидальной из-за присутствия экспериментального шума. Был обнаружен линейный режим, при котором G ’и G ” остаются постоянными при низких деформациях с критическими деформациями ниже 1%, которые слабо зависят от концентрации, тогда как верхний предел напряжения области линейного вязкоупругого режима увеличивается с концентрацией.После этой критической деформации G ‘и G ”уменьшаются, поскольку деформация увеличивается в два этапа, что может соответствовать, во-первых, разрушению структуры, а затем ориентации агломератов, совпадающей с полем потока при больших деформациях [ 55]. Это двухступенчатое уменьшение представляет собой два пика, которые становятся более очевидными при более высоких концентрациях, которые ранее были описаны в литературе как привлекательная гелевая структура [55, 56]. На рисунке 8c показаны зависимости напряжения сдвига от деформации для испытаний на деформацию, где деформации на этих двух пиках обозначены стрелками.Модуль потерь явно уменьшается при деформации выше 1%, и не наблюдается тенденции к превышению, как это наблюдается в других наножидкостях [32]. Модули хранения ( G ’) и потери ( G ”). ( a ) модуль упругости, ( b ) модуль потерь и ( c ) напряжение сдвига ( σ ) как функция деформации () ) на угловой частоте 10 рад с −1 и температуре 303.15 К для различных концентраций A-TiO 2 / EG. ( d ) Хранение и ( e ) модули потерь как функция частоты ( ω ) при деформации 0,1% и температуре 303,15 K для различных концентраций A- TiO 2 / EG. Линия, 5 мас.%; круг, 10 мас.%; квадрат, 15 мас.%; алмаз, 20 мас.%; треугольник, 25 мас.%. Испытания на развертку частоты (для угловых частот от 0,1 до 600 рад / с -1 ) были выполнены для наножидкостей A-TiO 2 / EG, и была получена эволюция каждого модуля с частотой колебаний, как показано на рисунке 8в, г.Эти эксперименты проводились в линейной вязкоупругой области с использованием постоянного значения деформации 0,1% для всех наножидкостей. Оба модуля увеличиваются с концентрацией с заданной постоянной частотой, что означает, что когда содержание наночастиц увеличивается, гидродинамические взаимодействия, а также вероятность столкновения становятся важными, усиливая процессы агрегации. Во всех случаях модуль упругости выше вязкого на низких частотах, тогда как на высоких частотах происходит обратное, когда суспензии ведут себя как жидкость.Частоты кроссовера, где G ‘= G ”и обнаружено изменение вязкоупругого поведения, увеличиваются с концентрацией наночастиц примерно с 4 рад с -1 при концентрации от 10 мас.% До 15 рад с -1 при 25 мас.%. Это согласуется с тем фактом, что степень агломерации частиц более важна при самых высоких концентрациях, но выравнивание с потоком агрегатов достигается за более короткое время для более высоких концентраций.Этот анализ не проводился для самой низкой концентрации наножидкости (5 мас.%) Из-за наличия минимального крутящего момента используемого устройства. Кроме того, следует учитывать, что не учитывались те данные на повышенных частотах, при которых возникают проблемы инерции оборудования. Это было сделано с учетом зависимости между комплексной вязкостью и частотой. Модули потерь и накопления увеличиваются с увеличением частоты, особенно на частотах выше 10 рад / с -1 .Также можно заметить, что данные модуля упругости попадают на прямую линию для самых высоких частот. Наконец, мы хотим указать, что увеличение концентрации наночастиц приводит к увеличению образования агломерации частицы, но даже концентрация 5 мас.% Для наножидкости A-TiO 2 / EG не соответствует традиционным Правило Кокса-Мерца [57], η * ω≈ηγ˙] γ˙ = ω, η * — комплексная вязкость η * ≡ ( G´ + iG´´ ) / ω , что часто справедливо для ньютоновских или неструктурированных жидкостей.Наши данные демонстрируют, что правило Кокса-Мерца становится все более неприменимым по мере увеличения концентрации наночастиц.
 837 м 3
837 м 3  Для системы теплопередачи с этиленгликолем циркулирующий объем должен быть увеличен на по сравнению с системой только с водой.
Для системы теплопередачи с этиленгликолем циркулирующий объем должен быть увеличен на по сравнению с системой только с водой. Силикаты в автомобильных антифризах используются для защиты алюминиевых деталей двигателя.
Силикаты в автомобильных антифризах используются для защиты алюминиевых деталей двигателя. Точки кипения Растворы этиленгликоля
Точка кипения Раствор этиленгликоля
(% по объему) 0 10 20 30 40 50 60 70 80 90 100 Температура ( o F) 212 214 216 220 220 225 232 245 260 288 386 ( o C) 100 101. 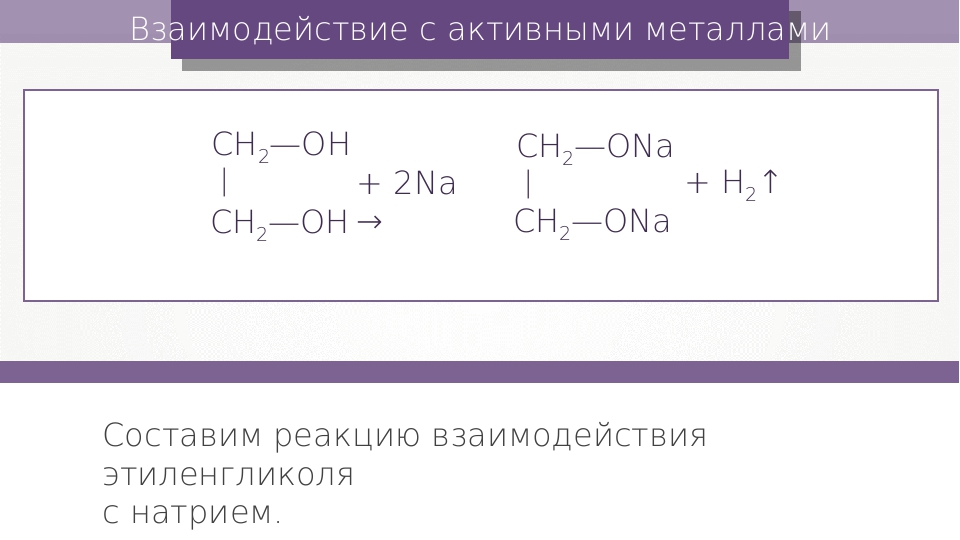 1
1 102,2 104,4 104,4 107,2 111,1 118 127 142 197 Требуется увеличение потока для раствора 50% этиленгликоля
Температура жидкости Увеличение расхода
(%) ( o F) ( o C) 40 4.4 22 100 37,8 16 140 60,0 15 180 82,2 14 220 104,4 14 Коррекция перепада давления и комбинированная поправка перепада давления и объемного расхода для 50% раствора этиленгликоля
Температура жидкости Коррекция падения давления при равных скоростях потока
(%) Комбинированная коррекция падения давления и расхода
(%) ( o F) ( o C) 4 0 4.  4
4 45 114 100 37,8 10 49 140 60,0 0 32 180 82,2 -6 23 220 104,4 -10 18 Этиленгликоль и пропиленгликоль: различия и области применения
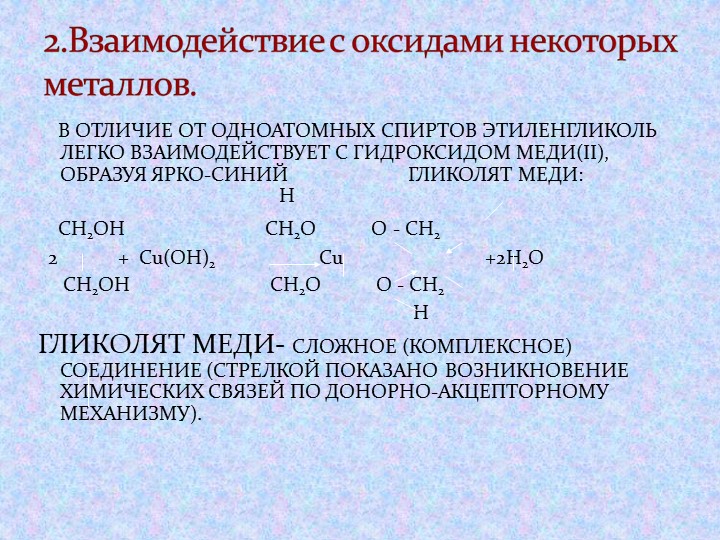 Между ними существуют некоторые важные различия, и их следует понять, прежде чем принимать решение.
Между ними существуют некоторые важные различия, и их следует понять, прежде чем принимать решение.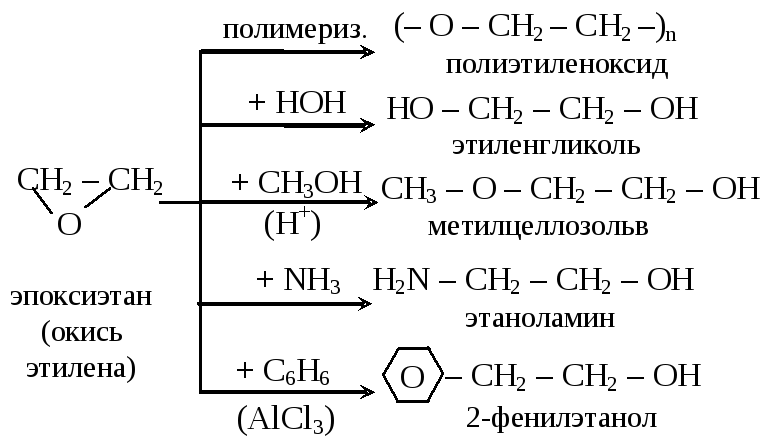 По сравнению с пропиленгликолем, о котором мы поговорим позже, этиленгликоль менее вязкий. Для теплопередачи более предпочтительна более низкая вязкость. Более высокая вязкость означает более высокие потери на трение, т. Е. Требуется больше энергии для перемещения более вязкого вещества через систему. Приложения, в которых требуется гликоль, также часто включают турбулизаторы, которые помогают минимизировать влияние вязкости гликоля за счет создания турбулентного потока.
По сравнению с пропиленгликолем, о котором мы поговорим позже, этиленгликоль менее вязкий. Для теплопередачи более предпочтительна более низкая вязкость. Более высокая вязкость означает более высокие потери на трение, т. Е. Требуется больше энергии для перемещения более вязкого вещества через систему. Приложения, в которых требуется гликоль, также часто включают турбулизаторы, которые помогают минимизировать влияние вязкости гликоля за счет создания турбулентного потока.

 По сравнению с этиленгликолем более высокая вязкость и потери на трение пропиленгликоля в сочетании с его более низкой теплоемкостью обычно ограничивают его использование в областях, связанных с проблемами безопасности.
По сравнению с этиленгликолем более высокая вязкость и потери на трение пропиленгликоля в сочетании с его более низкой теплоемкостью обычно ограничивают его использование в областях, связанных с проблемами безопасности.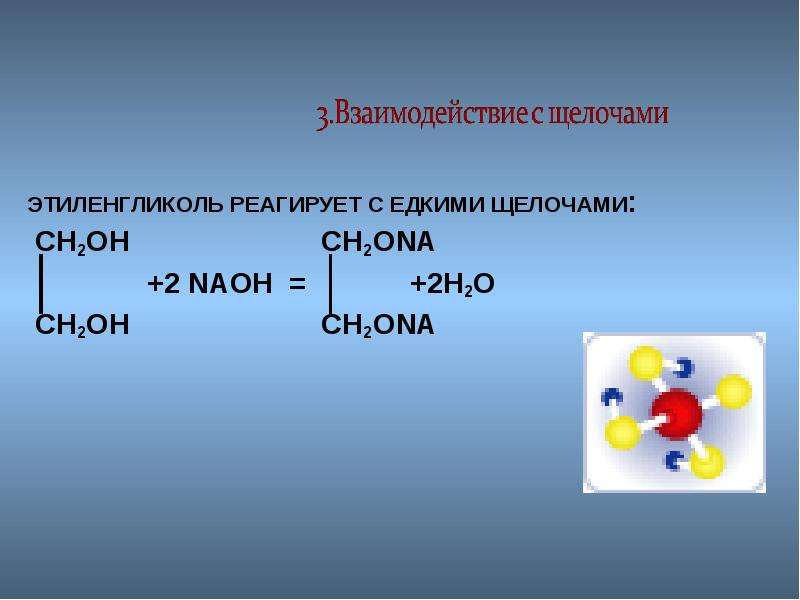
Этиленгликоль — обзор
11.4.3 Механизм коррозии
 Следовательно, удельное сопротивление раствора этиленгликоля будет уменьшаться с увеличением содержания воды. Более того, разбавление водой способствует гидролизу гидроксильных групп этиленгликоля, что также приводит к увеличению проводимости.Измеренное в лаборатории удельное сопротивление 33 об.% Раствора этиленгликоля составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). . Следовательно, высокое сопротивление раствора играет важную роль в коррозии.
Следовательно, удельное сопротивление раствора этиленгликоля будет уменьшаться с увеличением содержания воды. Более того, разбавление водой способствует гидролизу гидроксильных групп этиленгликоля, что также приводит к увеличению проводимости.Измеренное в лаборатории удельное сопротивление 33 об.% Раствора этиленгликоля составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). . Следовательно, высокое сопротивление раствора играет важную роль в коррозии. В эквивалентной схеме C d — это емкость не корродированной области образца магния, R pt и C pt — это сопротивление и емкость в нижней части корродирующего ( точечной коррозии), R ps — сопротивление раствора в яме, а R s — сопротивление раствора между электродом сравнения и образцом магния.Следовательно, общее сопротивление поляризации R p может быть выражено как: R p = R ps + R pt . Из-за высокого удельного сопротивления раствора отношение R ps к R pt очень велико ( R ps >> R pt ), и, следовательно, R p ≈ R пс .
В эквивалентной схеме C d — это емкость не корродированной области образца магния, R pt и C pt — это сопротивление и емкость в нижней части корродирующего ( точечной коррозии), R ps — сопротивление раствора в яме, а R s — сопротивление раствора между электродом сравнения и образцом магния.Следовательно, общее сопротивление поляризации R p может быть выражено как: R p = R ps + R pt . Из-за высокого удельного сопротивления раствора отношение R ps к R pt очень велико ( R ps >> R pt ), и, следовательно, R p ≈ R пс .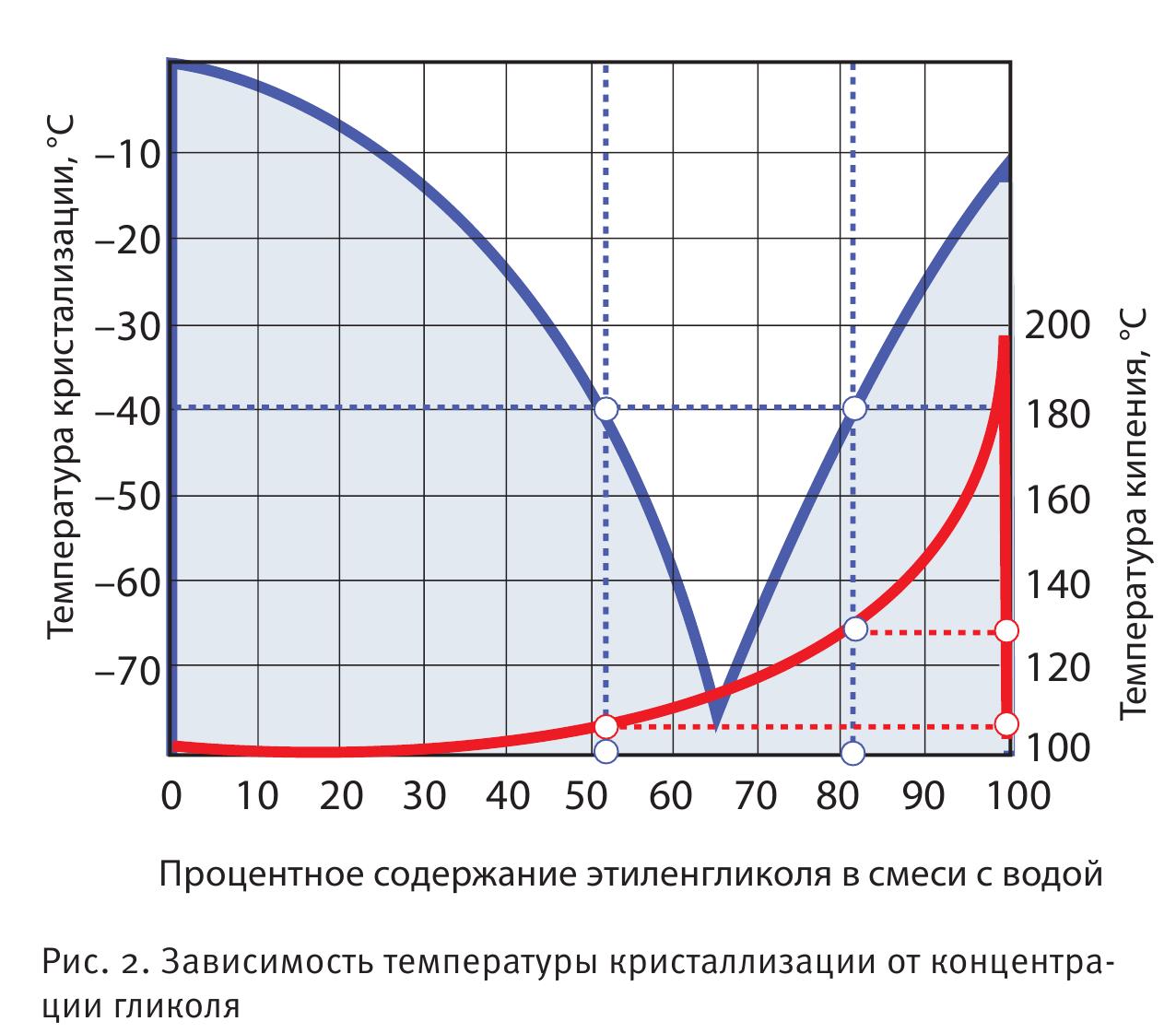 Вывод был подтвержден измеренной линейной зависимостью между сопротивлением поляризации и удельным сопротивлением раствора [27]; поскольку сопротивление раствора увеличивается с увеличением концентрации этиленгликоля, сопротивление поляризации также увеличивается.Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис. 11.2).
Вывод был подтвержден измеренной линейной зависимостью между сопротивлением поляризации и удельным сопротивлением раствора [27]; поскольку сопротивление раствора увеличивается с увеличением концентрации этиленгликоля, сопротивление поляризации также увеличивается.Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис. 11.2). 11.3).
11.3). Другими словами, поверхность магния более полно покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, который более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис.11.2).
Другими словами, поверхность магния более полно покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, который более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис.11.2). Достаточно всего нескольких адсорбированных ионов хлорида, чтобы значительно ускорить растворение магния на адсорбированных участках. Таким образом, скорость коррозии магния выше в хлоридсодержащем растворе этиленгликоля, чем в растворе этиленгликоля, содержащем Na 2 SO 4 или NaHCO 3 .
Достаточно всего нескольких адсорбированных ионов хлорида, чтобы значительно ускорить растворение магния на адсорбированных участках. Таким образом, скорость коррозии магния выше в хлоридсодержащем растворе этиленгликоля, чем в растворе этиленгликоля, содержащем Na 2 SO 4 или NaHCO 3 . С одной стороны, ингибирующий эффект Na 2 SO 4 или NaHCO 3 приводит к пассивации.С другой стороны, добавление Na 2 SO 4 или NaHCO 3 в хлоридсодержащий раствор этиленгликоля снижает стойкость раствора, что приводит к снижению коррозионной стойкости. После того как большая часть адсорбированных хлорид-ионов на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может только уменьшить R s раствора. Следовательно, скорость коррозии магния сначала уменьшается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 .
С одной стороны, ингибирующий эффект Na 2 SO 4 или NaHCO 3 приводит к пассивации.С другой стороны, добавление Na 2 SO 4 или NaHCO 3 в хлоридсодержащий раствор этиленгликоля снижает стойкость раствора, что приводит к снижению коррозионной стойкости. После того как большая часть адсорбированных хлорид-ионов на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может только уменьшить R s раствора. Следовательно, скорость коррозии магния сначала уменьшается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 . Произошла ошибка при настройке пользовательского файла cookie
Настройка вашего браузера для приема файлов cookie
 Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
Почему этому сайту требуются файлы cookie?
Что сохраняется в файле cookie?
Произошла ошибка при настройке пользовательского файла cookie
Настройка вашего браузера для приема файлов cookie
Почему этому сайту требуются файлы cookie?
Что сохраняется в файле cookie?
Разница между пропиленгликолем и этиленгликолем в антифризе
Что такое гликоли?
Что такое антифриз?
В чем разница между пропиленгликолем и этиленгликолем?
Реологические и объемные свойства наножидкостей TiO2-этиленгликоль | Письма о наноразмерных исследованиях
Объемные свойства
Реологическое поведение

 Гликоль обладает высокой химической активностью, поэтому используется в качестве растворителя, средства защиты изофорона и карбонильных групп. Спирт не кипит при высоких температурах, за чет чего подходит для специальной авиационной жидкости. Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
Гликоль обладает высокой химической активностью, поэтому используется в качестве растворителя, средства защиты изофорона и карбонильных групп. Спирт не кипит при высоких температурах, за чет чего подходит для специальной авиационной жидкости. Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.