Этиленгликоль растворимость в воде: Этиленгликоль ГОСТ 19710-83. Оптом со склада!
Этиленгликоль ГОСТ 19710-83. Оптом со склада!
Таблица плотности Этиленгликоля и водных растворов
Этиленгликоль ГОСТ 19710-83
Этиленгликоль (1,2-этандиол, лат. варианты названий: 1,2-Etandiol, Etylenglykol, Dihydroxietan, Monoetylenglykol) — органическое соединение, предельный двухатомный спирт, получаемый гидратацией этиленоксида или 1,2-дихлорэтана.
Ограниченно растворим в диэтиловом эфире, четыреххлористом углероде, бензоле, толуоле, хлороформе. Этиленгликоль практически не растворяет минеральные масла, поливинилхлорид, парафины, каучук; плохо растворяет растительные и животные масла. Растворение этиленгликоля в воде сопровождается выделением теплоты и уменьшением объёма. Его водные растворы характеризуются низкими температурами замерзания.
Получение
В промышленности этиленгликоль получают путём гидрации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Наша компания производит на основе этиленгликоля в виде незамерзающих водных растворов, антифризов и теплоносителей для промышленных и бытовых систем отопления и холодоснабжения серию продуктов с различной концентрацией этиленгликоля:
этиленгликоль 30%, этиленгликоль 40%, этиленгликоль 45%, этиленгликоль 50% и этиленгликоль 65% .
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Применение
Благодаря своей дешевизне Этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −45 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров
- В производстве целлофана, полиуретанов и ряда других. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:В составах для противообледенительной обработки лобовых стёкол и самолётов.

- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.
- В качестве высокотемпературного растворителя.
- В качестве криопротектора.
- Для поглощения воды, для предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенириуют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- компонент в составе систем жидкостного охлаждения компьютеров
- как теплоноситель в чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом.
Этиленгликоль — густая бесцветная жидкость, без запаха, сладкая на вкус, ядовита.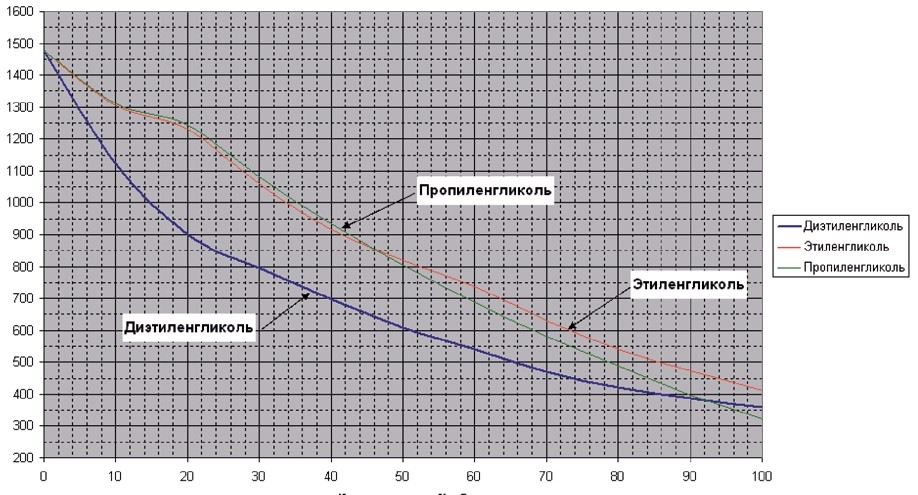
Этиленгликоль обладает целым рядом уникальных свойств, благодаря которым применяется при производстве целого ряда незамерзающих жидкостей — водных растворов, теплоносителей и антифризов для систем отопления и промышленного холодоснабжения: 1) этиленгликоль хорошо растворяется в воде в любых соотношениях, с концентрацией от 0% и до 100%; 2) этиленгликоль придает водным растворам незамерзающие (низкозамерзающие) свойства и температура начала замерзания зависит от концентрации самого этиленгликоля в воде; 3) этиленгликоль обладает хорошими гигроскопическими свойствами — свойствами впитывать, поглощать влагу, воду из поверхностей и воздуха, осушая её; 4) этиленгликоль хорошо растворяет не растворимые или слабо растворимые друг в друге вещества — гидрофобные и гидрофильные соединения. Благодаря всем перечисленным свойствам этиленгликоль является незаменимым компонентом при производстве незамерзающих жидкостей.
Этиленгликоль является активным коррозионным веществом, относится к жирным органическим соединениям, в связи с чем при производстве водных растворов — незамерзающих жидкостей необходимо использовать присадки для защиты систем от коррозии и пенообразований.
Этиленгликоль воды из углеводородов — Справочник химика 21
Определение этиленгликоля. Молекулярный вес 62. Этиленгликоль легко смешивается с водой, этанолом и ацетоном. Не смешивается с углеводородами, в частности с бензином. Температура кипения этиленгликоля 197°, а плотность 1,114 г/с.и . Температура замерзания —11,5°. Смеси этиленгликоля с водой замерзают при более низкой температуре. Самую низкую температуру замерзания (—75°) имеет смесь, содержащая 33% воды. Эти свойства этиленгликоля широко используют для приготовления низкозамерзающих жидкостей. Поэтому важно определять содержание этиленгликоля не только в товарном продукте, но и в водно-гликолевых смесях.
Простейший двухатомный спирт — этиленгликоль легко смешивается с водой, этиловым спиртом, ацетоном и некоторыми другими органическими веществами, но не смешивается с углеводородами и, в частности, с бензином. Наличие второй гидроксильной группы повышает плотность и температуру кипения этиленгликоля по сравнению с этиловым спиртом. Его температура кипения 197° С, а плотность 1,114 г см . Температура замерзания этиленгликоля — [c.296]
Этиленгликоль кипит при 197°. Он полностью смешивается с водой и спиртом, но нерастворим в некоторых углеводородах. Этиленгликоль вступает во все типичные реакции, обусловленные присутствием спиртового гидроксила, которые, однако, осложняются тем, что при соседнем атоме углерода находится вторая гидроксильная группа. Например, этиленгликоль образует с альдегидами и кетонами циклические ацетали и кетали
Алканы практически нерастворимы в воде и сами ее не растворяют, Так, в воде при 20 °С растворяется 2,065 % (по объему) бутана. В 100 г воды при 25 °С растворяется 0,005 г гептана, а в 100 г гептана в таких же условиях растворяется 0,0151 г воды. Алканы растворяют хлор, бром, иод, некоторые соли, например фторид бора (И1), хлорид кобальта (II), хлорид никеля (II), некоторые модификации серы, фосфора, хорошо растворимы в углеводородах и их галогенпроизводных, а также в простых и сложных эфирах. Хуже растворимы в этаноле, пиридине, алифатических аминах мало растворимы в метаноле, ацетоне, фурфуроле, феноле, анилине, нитробензоле и др. Практически нерастворимы в глицерине, этиленгликоле. Как правило, растворимость алканов падает с увеличением числа полярных групп в растворителе и возрастает с увеличением длины его углеродной цепи.
В 100 г воды при 25 °С растворяется 0,005 г гептана, а в 100 г гептана в таких же условиях растворяется 0,0151 г воды. Алканы растворяют хлор, бром, иод, некоторые соли, например фторид бора (И1), хлорид кобальта (II), хлорид никеля (II), некоторые модификации серы, фосфора, хорошо растворимы в углеводородах и их галогенпроизводных, а также в простых и сложных эфирах. Хуже растворимы в этаноле, пиридине, алифатических аминах мало растворимы в метаноле, ацетоне, фурфуроле, феноле, анилине, нитробензоле и др. Практически нерастворимы в глицерине, этиленгликоле. Как правило, растворимость алканов падает с увеличением числа полярных групп в растворителе и возрастает с увеличением длины его углеродной цепи.
Для приготовления композиций, ингибирующих коррозию, используют довольно щирокий круг растворителей метанол, этанол, этиленгликоль, воду, углеводороды [17].
Кроме того, для преодоления сил сцепления парафинов и остальных углеводородов масла используются специальные активаторы процесса комплексообразования к ним относятся метиловый и этиловый спирты или смеси их, ацетон, этиленгликоль, вода (в тех случаях, когда продукт или раствор его контактирует с сухим карбамидом). [c.223]
[c.223]
Низшие спирты, алифатические углеводороды Спирты, этиленгликоль, вода [c.383]
В состав смолистых веществ, которые образуются при сравнительно низких температурах (200—350°С), входят такие вещества, как вода, растворимые фенолы, этиленгликоль, алифатические углеводороды, спирты, кислоты, воск и т. д. Состав смолистых веществ сложен, [c.83]
Р-римость в воде 0,073% по массе (25 °С), воды в Б.-0,05% (26 °С). Неограниченно раств. в углеводородах, эфирах, хуже-в метаноле, не раств. в этиленгликоле, глицерине растворяет жиры, каучуки, гудрон, серу, фосфор, иод. Образует азеотропные смеси (см. табл.) [c.268]
Гликоли с короткой углеродной цепью, и прежде всего этиленгликоль, не растворяются в углеводородах и эфире, но смешиваются с водой и спиртами как растворители они ближе стоят к воде и метанолу, чем к обычным органическим растворителям. [c.108]
[c.108]
Если для углеводородов, хлороформа, метиленхлорида, эфиров ацетонитрила и спиртов значения г меньше единицы и имеют какое-либо определенное значение, то для воды, этиленгликоля, органических кислот б больше 1, что говорит о практически необратимой адсорбции этих растворителей на поверхности [c.33]
Питательные вещества поступают в бактериальную клетку через всю её поверхность. Они должны быть растворимы в воде, только при этом создаются условия для диффузии вещества в цитоплазму клетки. Часть органических веществ, которые совсем не растворяются в воде или дают коллоидные растворы, переводятся ферментами бактериальной клетки в водорастворимое состояние после их гидролиза до более простых и растворимых в воде соединений. Углеводороды легко проникают в бактериальную клетку. Труднее проникают молекулы вещества, содержащего полярные группы, и чем их больше, тем труднее проникновение (в ряду этанол этиленгликоль — глицерин проникновение уменьшается). Ещё медленнее диффундируют в клетку маннит и сахара, имеющие несколько оксигрупп и карбонильную. Жирные кислоты с одной карбоксильной группой легче проникают в цитоплазму, чем соответствующие им окси- или аминокислоты. [c.272]
Ещё медленнее диффундируют в клетку маннит и сахара, имеющие несколько оксигрупп и карбонильную. Жирные кислоты с одной карбоксильной группой легче проникают в цитоплазму, чем соответствующие им окси- или аминокислоты. [c.272]
П. у. хорошо растворимы в углеводородах, их галогенонроизводных (напр,, I4, 2h5 I2), простых и сложных эфирах хуже растворимы в этаноле, пиридине, алифатич аминах малорастворимы в метаноле, фурфуроле, феноле, анилине, нитробензоле и др. Практич. нерастворимы в глицерине, этиленгликоле, воде. Как правило, растворимость П, у, падает с увеличением числа полярных групп в растворителе и возрастает с увеличением длины углеродной цепи растворителя. [c.142]
Гере (475) исследовал более 100 органических жидкостей, стре- мясь найти такую, которая хорошо растворяла бы ароматические углеводороды и не растворяла бы вовсе жирные. Хуже всего жирные углеводороды растворяются в пировиноградной кислоте. Этиловый эфир винной кислоты действует вроде диметилсульфата, ацетоуксус-ный эфир но свойствам близок к анилину, а этиловый эфир ш,аве-левой кислоты напоминает в отношении избирательной растворимости уксусный ангидрид. Наиболее удобными растворителями оказались левулиновая кислота, фенилгидразин, неполный уксусный эфир этиленгликоля и фурфурол. Левулиновая кислота берется в кол1гчестве 3—4 объемов по отношению к бензину и удобна тем, что легко растворяется в воде, что делает возможным с одной стороны выделение извлеченных углеводородов, с другой — регенерацию ее. [c.170]
Наиболее удобными растворителями оказались левулиновая кислота, фенилгидразин, неполный уксусный эфир этиленгликоля и фурфурол. Левулиновая кислота берется в кол1гчестве 3—4 объемов по отношению к бензину и удобна тем, что легко растворяется в воде, что делает возможным с одной стороны выделение извлеченных углеводородов, с другой — регенерацию ее. [c.170]
Растворители, применяемые 1в процессе карбамидной депарафинизации, предназначены в основном для снижения вязкости сырья и создания необходимого контакта карбамида с углеводородами, что при прочих равных условиях обеспечивает большую-полноту извлечения комплексообразующих компонентов. Для создания гомогенной системы растворитель должен в той или иной степени растворять и сырье и карбамид. В качестве растворителей для карбамидной депарафинизации предложено много соединений (спирты и кетоны, хлористый метилен, дихлорэтан, ди-фтордихлорметан, бензол, крезол, этиленгликоль, уксусная кислота, изоо ктан, петролейный эфир, бензин, лигроин, а также вода или водные растворы низших спиртов).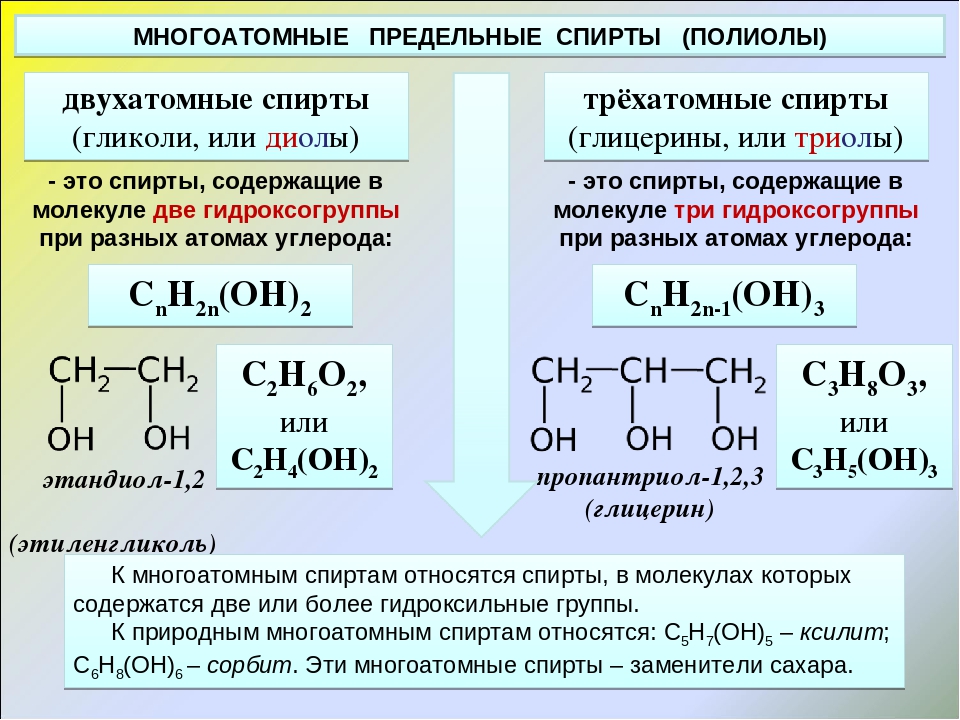 Однако далеко не все предложенные растворители нашли промышленное применение в—этом процессе. [c.215]
Однако далеко не все предложенные растворители нашли промышленное применение в—этом процессе. [c.215]
Наибольшее применение в качестве экстрагентов для извлечения ароматических углеводородов получили гликоли, сульфолан (тетрагидротиофендиоксид) [97, 99], диметилсульфоксид [99], N-метилпирролидон (в смеси с этиленгликолем и водой) [100. Первоначально использовали диэтиленгликоль, который в последнее время заменяется триэтиленгликолем [101] и тетраэтилен-гликолем [102]. В табл. 31 даны показатели экстракции с применением различных растворителей [79, с. 69]. [c.179]
Непрерывно действуюш ая осушка эти-ленгликолями сравнительно проста в эксплуатации и пе требует больших первоначальных капиталовложений [10]. На рис. IV.5 ириведена схема последней модификации обезвоживаюш,ей природный газ установки с этиленгликолем [15]. Влажный природный газ поступает в нижнюю часть скруббера 1, устанавливаемого как можно ближе к контактору 2 назначение скруббера — отделить жидкую воду, сконденсировавшиеся углеводороды, смазочное масло, ржавчину, частицы грунта и любую грязь, которая может попасть в трубопровод с газом. В контакторе 2 газ противотоком обрабатывается концентрированным раствором этиленгликоля. Разбавленный, отработанный раствор этиленгликоля сбрасывается регулятором уровня в газосенаратор 4, предпазначенный для отделения кислорода и сероводорода, иоглош енных этиленгликолем из газа в контакторе. Затем этиленгликоль проходит каменный или мешочный фильтр 6 для отделения взвешенных частиц грязи, ржавчины и пр. Через теплообменник 8 разбавленный этиленгликоль поступает в середину колонны-регенератора 9, где из него отгоняется вода. Тепло, необходимое для испарения воды, сообщается паровым, огневым или обогреваемым горячими нефтяными фракциями кипятильником 12. Вода ожижается в конденсаторе орошения 10 и насосом вновь подается па орошение регенератора 9. С низа колонны концентрированный раствор этиленгликоля выводится регулятором уровня в аккумулятор через тенлообменник 8. Отсюда циркуляционный насос 5 вновь подает этиленгликоль в контактор через холодильник 3. [c.154]
В контакторе 2 газ противотоком обрабатывается концентрированным раствором этиленгликоля. Разбавленный, отработанный раствор этиленгликоля сбрасывается регулятором уровня в газосенаратор 4, предпазначенный для отделения кислорода и сероводорода, иоглош енных этиленгликолем из газа в контакторе. Затем этиленгликоль проходит каменный или мешочный фильтр 6 для отделения взвешенных частиц грязи, ржавчины и пр. Через теплообменник 8 разбавленный этиленгликоль поступает в середину колонны-регенератора 9, где из него отгоняется вода. Тепло, необходимое для испарения воды, сообщается паровым, огневым или обогреваемым горячими нефтяными фракциями кипятильником 12. Вода ожижается в конденсаторе орошения 10 и насосом вновь подается па орошение регенератора 9. С низа колонны концентрированный раствор этиленгликоля выводится регулятором уровня в аккумулятор через тенлообменник 8. Отсюда циркуляционный насос 5 вновь подает этиленгликоль в контактор через холодильник 3. [c.154]
Адольф Вюрц (А. Уйг12), франдузский химик (1817 —1884). Ьл о работы в области органической химии весьма многочисленны. Им была открыта реакция синтеза предельных углеводородов (денствием металлического атрия на галоидпроизводные), реакции получения и обнаружения жирных аминов. В 1859 г. Вюрцем был получен первый представитель двухатомных алкого-лей —этиленгликоль ( удвоенный тип воды ). [c.51]
Уйг12), франдузский химик (1817 —1884). Ьл о работы в области органической химии весьма многочисленны. Им была открыта реакция синтеза предельных углеводородов (денствием металлического атрия на галоидпроизводные), реакции получения и обнаружения жирных аминов. В 1859 г. Вюрцем был получен первый представитель двухатомных алкого-лей —этиленгликоль ( удвоенный тип воды ). [c.51]
Время перехода электрона из своб. состояния в сольвати-рованное ири 295 К составляет (пс) 0,24 в воде, 5 в этиленгликоле, 11 в мегаиоле, 18 в этаноле, 51 в деканоле, 0,2 в аммиаке. При понижении т-ры это время увеличивается. Переход происходит через стадию образования локализованного (или предсольватированвого) электрона, характеризующегося меньшей энергией захвата средой. Ра-диац.-хим. выходы С. э. прп радиолизе равны 2,7-2,9 в воде, 1-1,8 в спиргах, 3,1 в аммиаке, 0,1-0,2 в нормальных углеводородах и до 1 в разветвленных углеводородах. [c.379]
Диметилсульфоксид (СНзЗОСНз), т. кип. 189°/760 мм (с разложением) или 85—87°/25 мм, имеет ряд преимуществ в качестве растворителя и в настоящее время находит широкое применение. По своей растворяющей способности он близок к диметилформамиду хорошо растворяет ацетилен, окись этилена, двуокись азота, сернистый ангидрид, многие ароматические вещества, гетероциклические соединения, камфору, смолы, сахара, жиры и т. д. Это бесцветная жидкость без запаха не смешивающаяся с насыщенными алифатическими углеводородами и смешивающаяся в любых отношениях с водой, метанолом, этанолом, этиленгликолем, глицерином, ацетоном, этилацетатом, диоксаном, пиридином и ароматическими углеводородами. Диметилсульфоксид растворяет и неорганические соли. Так, например, при 60° он растворяет 10,6% азотнокислого калия, 21,8% хлористого кальция и приблизительно 0,6% сульфата натрия и хлористого калия. [c.599]
кип. 189°/760 мм (с разложением) или 85—87°/25 мм, имеет ряд преимуществ в качестве растворителя и в настоящее время находит широкое применение. По своей растворяющей способности он близок к диметилформамиду хорошо растворяет ацетилен, окись этилена, двуокись азота, сернистый ангидрид, многие ароматические вещества, гетероциклические соединения, камфору, смолы, сахара, жиры и т. д. Это бесцветная жидкость без запаха не смешивающаяся с насыщенными алифатическими углеводородами и смешивающаяся в любых отношениях с водой, метанолом, этанолом, этиленгликолем, глицерином, ацетоном, этилацетатом, диоксаном, пиридином и ароматическими углеводородами. Диметилсульфоксид растворяет и неорганические соли. Так, например, при 60° он растворяет 10,6% азотнокислого калия, 21,8% хлористого кальция и приблизительно 0,6% сульфата натрия и хлористого калия. [c.599]
Этиленгликоль с выходом 88—97% от теоретического получается при гидроксилировании этилена перекисью водорода в растворе трет-бутилового спирта при температуре около О °С в присутствии 0з04. Гидроксилирование этилена может проводиться также водным 33%-ным раствором в присутствии стабилизаторов — перекисей алифатических и циклоалифатических гликолей, их неполных эфиров, несмешивающихся с водой спиртов и углеводородов [60]. [c.64]
Гидроксилирование этилена может проводиться также водным 33%-ным раствором в присутствии стабилизаторов — перекисей алифатических и циклоалифатических гликолей, их неполных эфиров, несмешивающихся с водой спиртов и углеводородов [60]. [c.64]
Склонность к гидро.пизу ограничивает применение сложных эфиров гликолей, полученных из окисей олефинов и низших кислот. Этиленгликольдиформиат предложено даже использовать в реакциях и процессах, где желательно постепенное образование муравьиной кислоты, В отсутствие воды сложные эфиры могут служить растворителями. Наиболее распространен диацетат этиленгликоля, как вы-сококипяш,ий, медленно испаряюш ийся растворитель эфиров целлюлозы и фторированных углеводородов. ]В смесях с другими растворителями он употребляется для очистки смазочных масел от свободных жирных кислот [2, р. 128]. [c.324]
Для выделения ароматических углеводородов из катализата риформинга применяется метод экстракции органическими растворителями. Так, бензол, толуол, ксилолы, этилбензол извлекают из катализата такими растворителями, как триэтиленгликоль, сульфолан, N-метшширролидон, N-формилморфолин и др. При экстракции используются также смеси растворителей с антирастворителями (водой, этиленгликолем). Последующей отгонкой растворителя и четкой ректификацией смеси аренов получают индивидуальные углеводороды. В отдельных случаях, например при выделении л-ксилола, используется кристаллизация. [c.773]
Так, бензол, толуол, ксилолы, этилбензол извлекают из катализата такими растворителями, как триэтиленгликоль, сульфолан, N-метшширролидон, N-формилморфолин и др. При экстракции используются также смеси растворителей с антирастворителями (водой, этиленгликолем). Последующей отгонкой растворителя и четкой ректификацией смеси аренов получают индивидуальные углеводороды. В отдельных случаях, например при выделении л-ксилола, используется кристаллизация. [c.773]
ЭТИЛЕН КАРБОНАТ (гликолькарбонат) Н,С0С(0)0СН2, л 38,5-39 С, 243 °С 1,32218, и 1,4190 раств. в СП., эф., ацетоне, аром, углеводородах, уксусной к-те, воде, не раств. в алиф. леводородах, Sj. Получ. взаимод. окиси этилена с Oj в присут. галогенидов тетраалкиламмо-ния или галогенидов щел. металлов вэаимод. этиленгликоля с фосгеном. Примен. р-ритель полимеров (в т. ч. полиакрилонитрила, полиамидов, эфиров целлюлозы) экстрагент аром, углеводородов для интенсификации крашения [c.719]
Краун-эфиры синтезируют алкилированнем этиленгликоля, диэтиленгликоля НОСН2СН2ОСН2СН2ОН, триэтиленгликоля НОСН2СН2ОСН2СН2ОСН2СН2ОН подходящими реагентами, например 2,2 -дихлордиэтиловым эфиром 0(СН2СНгС1)2. Простейшие краун-эфиры являются бесцветными густыми жидкостями или низкоплавкими кристаллическими веществами, растворимыми как в углеводородах, так и в воде. [c.340]
Простейшие краун-эфиры являются бесцветными густыми жидкостями или низкоплавкими кристаллическими веществами, растворимыми как в углеводородах, так и в воде. [c.340]
Было найдено, что в качестве смазки для кранов, когда имеют дело с неполярными соединениями, вполне пригодна глицерино-крахмальная смазка [150]. Для этой же цели была рекомендована смесь сахарозы или маннита в глицерине, содержащая 1—3% поливинилового спирта средней вязкости [151]. Применялась также в качестве смазок при работе с алифатическими и ароматическими углеводородами частично этерифицированная и полимеризованная смесь тетра-этиленгликоля и лимонной кислоты [152] или такая же смесь с добавлением ацетата целлюлозы [153]. Спирты, кетоны и вода действуют на эту смесь. Смолоподобная смесь, полученная при реакции себациновой кислоты и этилен-гликоля, нерастворима в алифатических углеводородах, спиртах и диэтиловом эфире, но растворима в бензоле, пиридине и галоидалкилах [154]. Полимери-зованные фталевые эфиры ди- и триэтиленгликоля являются хорошими смазками при работе с алифатическими углеводородами [154]. Различные патентованные смеси, предлагаемые фабрикантами лабораторных приборов в качестве смазок для кранов, имеют обычно ограниченную применимость. [c.247]
Различные патентованные смеси, предлагаемые фабрикантами лабораторных приборов в качестве смазок для кранов, имеют обычно ограниченную применимость. [c.247]
Для титрования оснований в качестве сред довольно широко используются также гликолевые растворители, которые обладают более кислыми свюйствамм по сравнению с водой и спиртами [3]. Для уменьшения вязкости и повышения растворяющей способности к гликолям прибавляют спирты, углеводороды и кетоаы. Содержание гликоля может варьироваться в пределах от 15 до 70%, но стандартной растворяющей средой является смесь 1 1 (по объему). Наиболее часто применяют смеси этиленгликоля или про-пиленгликоля с изопропиловым или н-бутиловым спиртами. Хлороформ по сравнению со спиртами улучшает растворимость многих соединений и увеличивает резкость перехода окраски индикаторов. При использовании хлороформа используют пропиленгли-коль, так как с зтиленгликолем хлороформ не смешивается. [c.80]
Интересно отметить, что для экстракции толуола из богатых ароматическими углеводородами продуктов гидроформинга можно применять воду. Однако гораздо более удобным растворителем, который может конкурировать с 80г, является диэтилен-гликоль, используемый в процессе Юдекс . Селективность ди-этиленгликоля по отношению к ароматическим соединениям увеличивается при добавлении 5—12% воды. Этот растворитель, получающий все более широкое распространение, применяют под давлением при относительно высоких температурах (порядка 163° С). Так как диэтиленгликоль имеет высокую температуру кипения, регенерация его из экстракта происходит почти без потерь при этом теряется, скорее, некоторое количество углеводородов. [c.639]
Однако гораздо более удобным растворителем, который может конкурировать с 80г, является диэтилен-гликоль, используемый в процессе Юдекс . Селективность ди-этиленгликоля по отношению к ароматическим соединениям увеличивается при добавлении 5—12% воды. Этот растворитель, получающий все более широкое распространение, применяют под давлением при относительно высоких температурах (порядка 163° С). Так как диэтиленгликоль имеет высокую температуру кипения, регенерация его из экстракта происходит почти без потерь при этом теряется, скорее, некоторое количество углеводородов. [c.639]
Очевидно, что уравнение Цванцига не дает адекватного количественного описания поведения электролитов, остается неясным и область применимости этого уравнения. В значительной степени это зависит от справедливости закона Стокса. Однако всевозрастаюший объем данных заставляет усомниться в справедливости последнего. Наиболее подробно изучены системы, содержащие растворители с низкой вязкостью, такие, как низшие спирты, вода, ацетонитрил, ацетон, хлорированные углеводороды и различные смеси этих растворителей. В растворителях с высокой вязкостью, таких, как формамид [72], этиленгликоль [73], смесях сахароза — вода [73а], ацетонитрил -октацианэтил — сахароза [74], наблюдаются большие систематические отклонения от закона Стокса. В некоторых случаях произведение Вальдена в 2 — 3 раза превышает величину, рассчитанную теоретически. Аналогичная картина наблюдается при измерении электропроводности электролитов в мицеллярных растворах или гелях [75, 76] и диффузии инертных газов в растворах полимеров [77]. По-видимо-му, вязкие силы действуют на ион не так, как они действуют на макроскопическую сферу. В противоположность модели Эйнштейна - [c.32]
В растворителях с высокой вязкостью, таких, как формамид [72], этиленгликоль [73], смесях сахароза — вода [73а], ацетонитрил -октацианэтил — сахароза [74], наблюдаются большие систематические отклонения от закона Стокса. В некоторых случаях произведение Вальдена в 2 — 3 раза превышает величину, рассчитанную теоретически. Аналогичная картина наблюдается при измерении электропроводности электролитов в мицеллярных растворах или гелях [75, 76] и диффузии инертных газов в растворах полимеров [77]. По-видимо-му, вязкие силы действуют на ион не так, как они действуют на макроскопическую сферу. В противоположность модели Эйнштейна - [c.32]
Энтропия, энтальпия и удельная теплоемкость для метилового-и этилового спиртов, ацетилена, этилена, пропилена, воды, аммиака, сероводорода и цианистого водорода приводятся по данным Рибо [212] энтропия, энтальпия и свободная энергия для пропилового и бутилового спиртов, этиленгликоля, пропилена и воды — по данным Дяткиной [70]. Сведения относительно энергии образования непредельных углеводородов можно получить в работах Текера, Фолькинса и Миллера [257] и Фрэнсиса и Клейншмидта [85]. [c.191]
[c.191]
Этиленгликоль, пропиленгликоль
050 334 7373
096 544 7373
044 332 1425
Компания «Диамант» реализует по доступным ценам этиленгликоль, пропиленгликоль и водные растворы на их основе. Они широко применяются в качестве теплоносителя (антифриза, хладагента) в автономных отопительных системах и в системах промышленного кондиционирования общественных зданий и спортивных сооружений, различных производств, где технологически требуется поддержание в помещениях необходимой низкой температуры. При кристаллизации-замерзании водный раствор этиленгликоля принимает форму мягкой желеобразной массы(!), исключая при этом вероятность повреждения оборудования отопительной системы или системы промышленного кондиционирования.
Этиленгликоль представляет собой сиропообразную бесцветную прозрачную вязкую жидкость сладковатую на вкус и с незначительным запахом. Температура плавления ( кристаллизации, замерзания) равна минус 12.6°С, температура кипения 197.9°С, плотность при 20°С 1.11 г/см3, слабоиспаряем (малолетуч).
Температура плавления ( кристаллизации, замерзания) равна минус 12.6°С, температура кипения 197.9°С, плотность при 20°С 1.11 г/см3, слабоиспаряем (малолетуч).
Синонимы этиленгликоля: гликоль, моноэтиленгликоль, 1,2-диоксиэтан, этандиол-1,2. Этиленгликоль высшего сорта производится в соответствии с ГОСТ 19710-83.
Этиленгликоль растворяется в любых соотношениях в воде, спирте, ацетоне, но плохо растворим в эфире и совсем не растворим в хлороформе, в алифатических и ароматических углеводородах.
Химическая формула этиленгликоля: HO—Ch3—Ch3—OH
Водные растворы этиленгликоля (незамерзающие жидкости) кристаллизуются (замерзают) при достаточно низких температурах, поэтому очень широко применяются в качестве теплоносителя (антифриза, хладагента) в автономных отопительных системах и в системах промышленного кондиционирования.
Этиленгликоль и растворы на его основе отпускаются в емкостях 1 м.
 куб., в бочках 200 л. и 50л.
куб., в бочках 200 л. и 50л.Пропиленгликоль – гигроскопичная бесцветная жидкость, содержащая асимметричный атом углерода, растворимая в воде, этаноле, диэтиловом спирте, ацетоне и хлороформе. Он не вызывает коррозию, обладает очень низкой летучестью и очень низкой токсичностью.
Молекулярная формула пропиленгликоля – C3H8O2, молярная масса – 76.09 грамм/моль, плотность – 1,036 г/см³, температура плавления – -59°C, 214K, -74°F, температура кипения – 188,2°C, 461K, 371°F, теплопроводность – 0,34.
Свойства пропиленгликоля повышать и понижать температуру жидкостей позволяют использовать его в составах антиобледенительных жидкостей для самолетов и антифризов для автомобилей, в системах кондиционирования, вентиляции и отопления жилых помещений, в системах охлаждения пищевых продуктов и другом теплообменном оборудовании.
Применение пропиленгликоля считается безопасным для производства продовольственных продуктов и медикаментов. Пищевой пропиленгликоль используется в качестве добавки E1520, которая является растворителем и консервантом пищевых продуктов, а также используется для табачных изделий и в кормах для животных, является основным ингредиентом в жидкостях, используемых в электронных сигаретах.
Пищевой пропиленгликоль используется в качестве добавки E1520, которая является растворителем и консервантом пищевых продуктов, а также используется для табачных изделий и в кормах для животных, является основным ингредиентом в жидкостях, используемых в электронных сигаретах.
Пропиленгликоль и растворы на его основе отпускаются в емкостях 1 м.куб., в бочках 200 л. и 50л.
Мы доставим приобретенный Вами товар в любую точку Украины. Позвоните нам, и мы поможем Вам создать заказ, проконсультируем, ознакомим с техническими характеристиками растворов, а возможно и предоставим скидку на Вашу покупку.
Наша продукция всегда качественная и по лучшей цене
044 332 1425
050 334 7373
096 544 7373
Этиленгликоль.
 Мини-справочник по химическим веществам (3340 веществ)
Мини-справочник по химическим веществам (3340 веществ)Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Синонимы:
1,2-этандиол
гликоль
Внешний вид:
бесцветн. жидкость
Брутто-формула (система Хилла): C
2H6O2Формула в виде текста: HOCh3Ch3OH
Молекулярная масса (в а.е.м.): 62,07
Температура плавления (в °C): -12,6
Температура кипения (в °C): 197,85
Температурные константы смесей:
181 °C (температура кипения азеотропа, давление 1 атм) анилин 76% этиленгликоль 24%
Растворимость (в г/100 г или характеристика):
вода: смешиваетсядиэтиловый эфир: 7,89 (20°C)
этанол: смешивается
Вкус, запах, гигроскопичность:
вкус: сладкий
Плотность:
1,1155 (20°C, г/см3)Показатель преломления (для D-линии натрия):
1,43192 (20°C)Давление паров (в мм.
 рт.ст.): 13 (93°C)
рт.ст.): 13 (93°C)25 (109°C)
Стандартная энтальпия образования ΔH (298 К, кДж/моль):
-454,3 (ж)Стандартная энергия Гиббса образования ΔG (298 К, кДж/моль):
-322,7 (ж)Стандартная энтропия образования S (298 К, Дж/моль·K):
166,9 (ж)Энтальпия плавления ΔH
пл (кДж/моль): 11,23Теплота сгорания Q
p(кДж/моль): 1179,5- Рабинович В.А., Хавин З.Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 198
Источники информации:
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Еще по теме:
РАСТВОРИМОСТЬ КОМПОНЕНТОВ ФОТОЧУВСТВИТЕЛЬНОЙ КОМПОЗИЦИИ НА ОСНОВЕ АЦЕТАТА МЕДИ И НАТРИЕВЫХ СОЛЕЙ АНТРАХИНОНСУЛЬФОКИСЛОТ
TY — JOUR
T1 — РАСТВОРИМОСТЬ КОМПОНЕНТОВ ФОТОЧУВСТВИТЕЛЬНОЙ КОМПОЗИЦИИ НА ОСНОВЕ АЦЕТАТА МЕДИ И НАТРИЕВЫХ СОЛЕЙ АНТРАХИНОНСУЛЬФОКИСЛОТ
AU — Брусницына, Л. А.
А.
AU — Алексеева, Т. А.
AU — Степановских, Е. И.
PY — 2018
Y1 — 2018
N2 — В фотоаддитивной технологии изготовления печатных можно выделить две основные стадии: 1) формирование рисунка схемы печатной платы; 2) наращивание металлического покрытия в растворах химического меднения. Качество медного покрытия во многом определяется структурой сухого слоя фотоактиватора. Для фотоактивации поверхности диэлектрических материалов в аддитивной технологии изготовления печатных плат используются фоточувствительные композиции, содержащие фотопро-мотор — ацетат меди, оптический сенсибилизатор — натриевую соль антрахинон-2-сульфокислоты или динатриевую соль антрахинон-2,6-сульфокислоты, вторичный восстановитель — сорбит, пентаэритрит, этиленгликоль, лимонную кислоту. Строение сухого фоточувствительного слоя определяется последовательностью выделения из раствора компонентов фоточувствительной композиции в условиях равновесной кристаллизации, которая обусловлена растворимости компонентов в жидкой фазе при различных температурах. С целью выяснения поведения компонентов фоточувствительной композиции в процессе сушки проведено изучение растворимости в воде в интервале температур 293-353 K основных компонентов фотокомпозиции: ацетата меди, натриевых солей антрахинонсульфокислот, пентаэритрита и сорбита. Определены величины мольной энтальпии растворения в воде: для ацетата меди она составляет 3.02 кДж/моль, натриевой соли антрахинон-2-сульфокислоты — 32.84 кДж/моль, динатриевой соли антра-хинон-2,6-сульфокислоты — 23.76 кДж/моль, сорбита — 7.05 кДж/моль, пентаэритрита — 13.3 кДж/моль, лимонной кислоты — 8.38 кДж/моль. Изучена растворимость динатриевой соли анрахинон-2,6-сульфокислоты в бинарных раство-рителях, содержащих воду и этиленгликоль, в интервале температур 293-353 K. Определены величины мольной энтальпии растворения в растворителях разного состава. Эндотермичность растворения уменьшается с увеличением содержания этиленгликоля, что свидетельствует о меньшей сольватирующей способности смешанного растворителя.
С целью выяснения поведения компонентов фоточувствительной композиции в процессе сушки проведено изучение растворимости в воде в интервале температур 293-353 K основных компонентов фотокомпозиции: ацетата меди, натриевых солей антрахинонсульфокислот, пентаэритрита и сорбита. Определены величины мольной энтальпии растворения в воде: для ацетата меди она составляет 3.02 кДж/моль, натриевой соли антрахинон-2-сульфокислоты — 32.84 кДж/моль, динатриевой соли антра-хинон-2,6-сульфокислоты — 23.76 кДж/моль, сорбита — 7.05 кДж/моль, пентаэритрита — 13.3 кДж/моль, лимонной кислоты — 8.38 кДж/моль. Изучена растворимость динатриевой соли анрахинон-2,6-сульфокислоты в бинарных раство-рителях, содержащих воду и этиленгликоль, в интервале температур 293-353 K. Определены величины мольной энтальпии растворения в растворителях разного состава. Эндотермичность растворения уменьшается с увеличением содержания этиленгликоля, что свидетельствует о меньшей сольватирующей способности смешанного растворителя.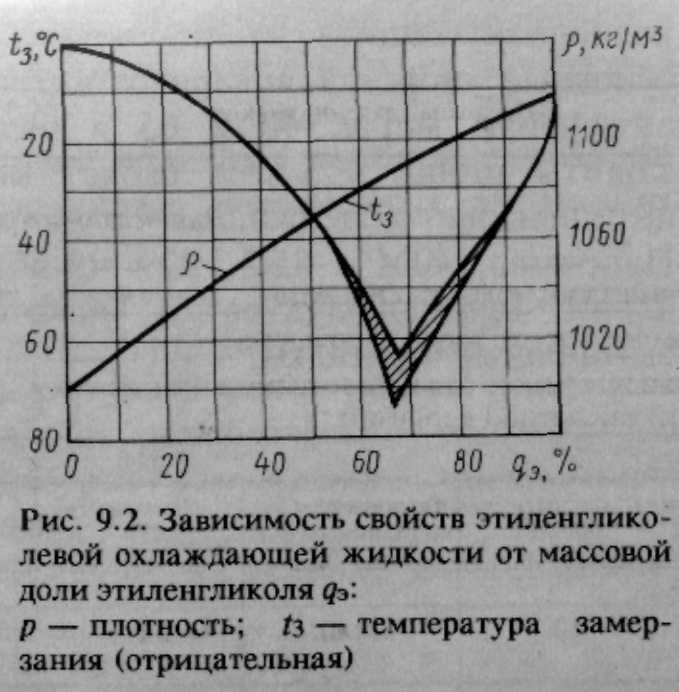 Действительно, этиленгликоль является менее полярным растворителем по сравнению с водой и хуже образует водородные связи. Поэтому введение этиленгликоля в состав смешанного растворителя приводит к меньшей сольватации молекулы динатриевой соли анрахинон-2,6-сульфокислоты. С другой стороны, необходимо учитывать и изменения в структуре смешанного растворителя вода-этиленгликоль при увеличении содержания этиленгликоля. Введение в состав растворителя этиленгликоля приводит к снижению растворимости динат-риевой соли анрахинон-2,6-сульфокислоты и чем выше температура растворения, тем влияние этиленгликоля сказывается больше. Исходя из этого, можно сделать вывод о том, что присутствие этиленгликоля в составе фотокомпозиции нежелательно. Из всех компонентов фоточувствительной композиции меньшей растворимостью в воде обладают натриевые соли антрахинонсульфокислот. Растворимость ацетата меди и пентаэритрита несколько выше, а растворимость сорбита и лимонной кислоты на порядок превышает растворимость в воде остальных компонентов фотокомпозиции.
Действительно, этиленгликоль является менее полярным растворителем по сравнению с водой и хуже образует водородные связи. Поэтому введение этиленгликоля в состав смешанного растворителя приводит к меньшей сольватации молекулы динатриевой соли анрахинон-2,6-сульфокислоты. С другой стороны, необходимо учитывать и изменения в структуре смешанного растворителя вода-этиленгликоль при увеличении содержания этиленгликоля. Введение в состав растворителя этиленгликоля приводит к снижению растворимости динат-риевой соли анрахинон-2,6-сульфокислоты и чем выше температура растворения, тем влияние этиленгликоля сказывается больше. Исходя из этого, можно сделать вывод о том, что присутствие этиленгликоля в составе фотокомпозиции нежелательно. Из всех компонентов фоточувствительной композиции меньшей растворимостью в воде обладают натриевые соли антрахинонсульфокислот. Растворимость ацетата меди и пентаэритрита несколько выше, а растворимость сорбита и лимонной кислоты на порядок превышает растворимость в воде остальных компонентов фотокомпозиции.
AB — В фотоаддитивной технологии изготовления печатных можно выделить две основные стадии: 1) формирование рисунка схемы печатной платы; 2) наращивание металлического покрытия в растворах химического меднения. Качество медного покрытия во многом определяется структурой сухого слоя фотоактиватора. Для фотоактивации поверхности диэлектрических материалов в аддитивной технологии изготовления печатных плат используются фоточувствительные композиции, содержащие фотопро-мотор — ацетат меди, оптический сенсибилизатор — натриевую соль антрахинон-2-сульфокислоты или динатриевую соль антрахинон-2,6-сульфокислоты, вторичный восстановитель — сорбит, пентаэритрит, этиленгликоль, лимонную кислоту. Строение сухого фоточувствительного слоя определяется последовательностью выделения из раствора компонентов фоточувствительной композиции в условиях равновесной кристаллизации, которая обусловлена растворимости компонентов в жидкой фазе при различных температурах. С целью выяснения поведения компонентов фоточувствительной композиции в процессе сушки проведено изучение растворимости в воде в интервале температур 293-353 K основных компонентов фотокомпозиции: ацетата меди, натриевых солей антрахинонсульфокислот, пентаэритрита и сорбита.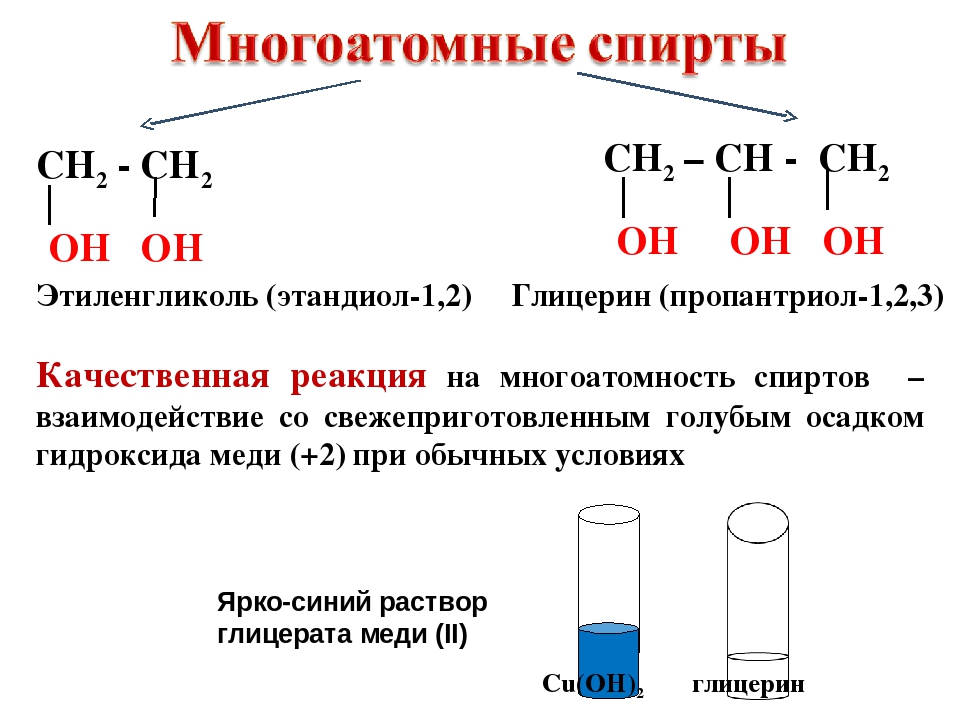 Определены величины мольной энтальпии растворения в воде: для ацетата меди она составляет 3.02 кДж/моль, натриевой соли антрахинон-2-сульфокислоты — 32.84 кДж/моль, динатриевой соли антра-хинон-2,6-сульфокислоты — 23.76 кДж/моль, сорбита — 7.05 кДж/моль, пентаэритрита — 13.3 кДж/моль, лимонной кислоты — 8.38 кДж/моль. Изучена растворимость динатриевой соли анрахинон-2,6-сульфокислоты в бинарных раство-рителях, содержащих воду и этиленгликоль, в интервале температур 293-353 K. Определены величины мольной энтальпии растворения в растворителях разного состава. Эндотермичность растворения уменьшается с увеличением содержания этиленгликоля, что свидетельствует о меньшей сольватирующей способности смешанного растворителя. Действительно, этиленгликоль является менее полярным растворителем по сравнению с водой и хуже образует водородные связи. Поэтому введение этиленгликоля в состав смешанного растворителя приводит к меньшей сольватации молекулы динатриевой соли анрахинон-2,6-сульфокислоты. С другой стороны, необходимо учитывать и изменения в структуре смешанного растворителя вода-этиленгликоль при увеличении содержания этиленгликоля.
Определены величины мольной энтальпии растворения в воде: для ацетата меди она составляет 3.02 кДж/моль, натриевой соли антрахинон-2-сульфокислоты — 32.84 кДж/моль, динатриевой соли антра-хинон-2,6-сульфокислоты — 23.76 кДж/моль, сорбита — 7.05 кДж/моль, пентаэритрита — 13.3 кДж/моль, лимонной кислоты — 8.38 кДж/моль. Изучена растворимость динатриевой соли анрахинон-2,6-сульфокислоты в бинарных раство-рителях, содержащих воду и этиленгликоль, в интервале температур 293-353 K. Определены величины мольной энтальпии растворения в растворителях разного состава. Эндотермичность растворения уменьшается с увеличением содержания этиленгликоля, что свидетельствует о меньшей сольватирующей способности смешанного растворителя. Действительно, этиленгликоль является менее полярным растворителем по сравнению с водой и хуже образует водородные связи. Поэтому введение этиленгликоля в состав смешанного растворителя приводит к меньшей сольватации молекулы динатриевой соли анрахинон-2,6-сульфокислоты. С другой стороны, необходимо учитывать и изменения в структуре смешанного растворителя вода-этиленгликоль при увеличении содержания этиленгликоля.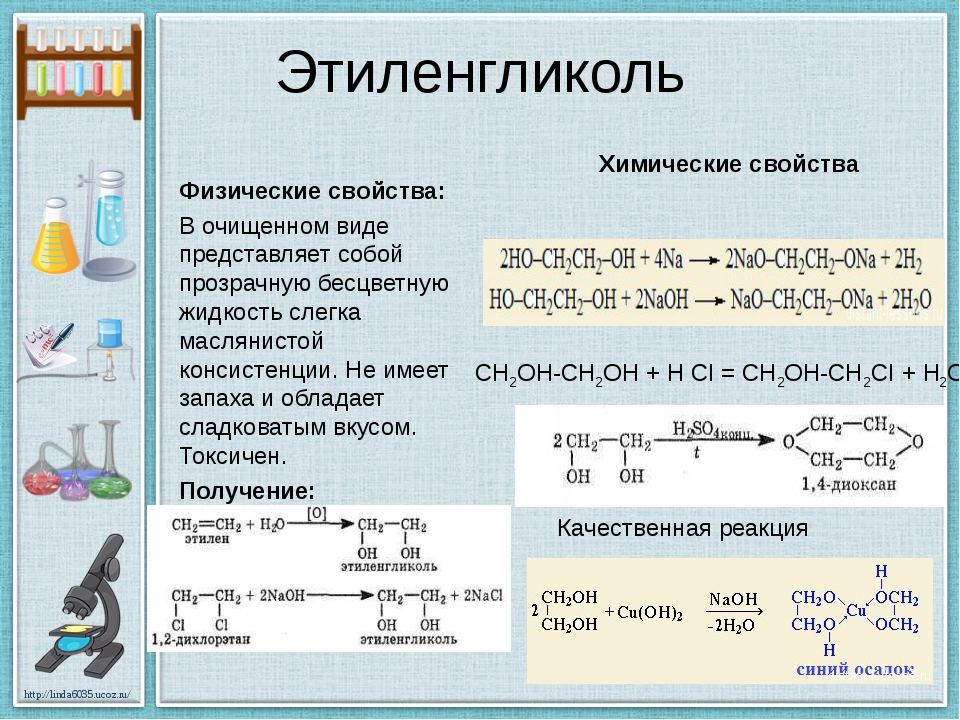 Введение в состав растворителя этиленгликоля приводит к снижению растворимости динат-риевой соли анрахинон-2,6-сульфокислоты и чем выше температура растворения, тем влияние этиленгликоля сказывается больше. Исходя из этого, можно сделать вывод о том, что присутствие этиленгликоля в составе фотокомпозиции нежелательно. Из всех компонентов фоточувствительной композиции меньшей растворимостью в воде обладают натриевые соли антрахинонсульфокислот. Растворимость ацетата меди и пентаэритрита несколько выше, а растворимость сорбита и лимонной кислоты на порядок превышает растворимость в воде остальных компонентов фотокомпозиции.
Введение в состав растворителя этиленгликоля приводит к снижению растворимости динат-риевой соли анрахинон-2,6-сульфокислоты и чем выше температура растворения, тем влияние этиленгликоля сказывается больше. Исходя из этого, можно сделать вывод о том, что присутствие этиленгликоля в составе фотокомпозиции нежелательно. Из всех компонентов фоточувствительной композиции меньшей растворимостью в воде обладают натриевые соли антрахинонсульфокислот. Растворимость ацетата меди и пентаэритрита несколько выше, а растворимость сорбита и лимонной кислоты на порядок превышает растворимость в воде остальных компонентов фотокомпозиции.
UR — https://elibrary.ru/item.asp?id=35051303
M3 — Статья
VL — 54
SP — 98
EP — 104
JO — Бутлеровские сообщения
JF — Бутлеровские сообщения
SN — 2074-0212
IS — 5
ER —
Этиленгликоль — Ethylene glycol — qaz.wiki
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC | |||
| Другие названия Этиленгликоль | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| 3DMet | |||
| Сокращения | МЭГ | ||
| 505945 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100. 003.159 003.159 | ||
| Номер ЕС | |||
| 943 | |||
| КЕГГ | |||
| MeSH | Этилен + гликоль | ||
| Номер RTECS | |||
| UNII | |||
| Номер ООН | 3082 | ||
| |||
| Свойства | |||
| С 2 Н 6 О 2 | |||
| Молярная масса | 62,068 г · моль -1 | ||
| вид | Прозрачная бесцветная жидкость | ||
| Запах | Без запаха | ||
| Плотность | 1,1132 г / см 3 | ||
| Температура плавления | -12,9 ° С (8,8 ° F, 260,2 К) | ||
| Точка кипения | 197,3 ° С (387,1 ° F, 470,4 К) | ||
| Смешиваемый | |||
| Растворимость | Растворим в большинстве органических растворителей | ||
| журнал P | -1,69 | ||
| Давление газа | 0,06 мм рт. Ст. (20 ° C) Ст. (20 ° C) | ||
| Вязкость | 1,61 × 10 -2 Па · с | ||
| Опасности | |||
| Основные опасности | Вредный | ||
| Паспорт безопасности | См .: страницу данных Внешний паспорт безопасности материала | ||
| Пиктограммы GHS | |||
| Сигнальное слово GHS | Предупреждение | ||
| h402 , h473 | |||
| P260 , P264 , P270 , «> P301 + 312 , P314 , P330 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 111 ° C (232 ° F, 384 K) закрытая чашка | ||
| 410 ° С (770 ° F, 683 К) | |||
| Пределы взрываемости | 3,2–15,2% | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
| Никто | |||
| REL (рекомендуется) | Не установлено | ||
| IDLH (Непосредственная опасность) | Никто | ||
| Родственные соединения | |||
| Пропиленгликоль Диэтиленгликоль Триэтиленгликоль Полиэтиленгликоль | |||
| Страница дополнительных данных | |||
| Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т.  Д. Д. | |||
Термодинамические | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ , ИК , ЯМР , МС | |||
| N проверить ( что есть ?) Y N | |||
| Ссылки на инфобоксы | |||
Этиленгликоль ( название IUPAC : этан-1,2-диол) представляет собой органическое соединение с формулой (CH 2 OH) 2 . Он в основном используется для двух целей: в качестве сырья при производстве полиэфирных волокон и для составов антифризов . Это вязкая жидкость без запаха, цвета, сладкого вкуса.
Производство
Промышленные маршруты
Этиленгликоль получают из этилена (этена) через промежуточный оксид этилена . Оксид этилена реагирует с водой с образованием этиленгликоля в соответствии с химическим уравнением :
- С 2 Н 4 О + Н 2 О → НО-СН 2 СН 2 -ОН
Эта реакция может быть катализируемой с помощью либо кислот или оснований , или может иметь место при нейтральном значении рН при повышенных температурах. Самый высокий выход этиленгликоля происходит при кислом или нейтральном pH с большим избытком воды. В этих условиях можно достичь выхода этиленгликоля 90%. Основными побочными продуктами являются олигомеры диэтиленгликоль , триэтиленгликоль и тетраэтиленгликоль . Разделение этих олигомеров и воды требует больших затрат энергии. Ежегодно производится около 6,7 млн тонн.
Самый высокий выход этиленгликоля происходит при кислом или нейтральном pH с большим избытком воды. В этих условиях можно достичь выхода этиленгликоля 90%. Основными побочными продуктами являются олигомеры диэтиленгликоль , триэтиленгликоль и тетраэтиленгликоль . Разделение этих олигомеров и воды требует больших затрат энергии. Ежегодно производится около 6,7 млн тонн.
Более высокая селективность достигается за счет использования Shell «ы процесса OMEGA . В процессе OMEGA оксид этилена сначала превращается в диоксид углерода ( CO
2 ) до этиленкарбоната . Затем это кольцо гидролизуют основным катализатором на второй стадии с получением моноэтиленгликоля с селективностью 98%. На этом этапе снова выделяется углекислый газ, который может быть снова подан в технологический контур. Углекислый газ частично поступает из производства окиси этилена, где часть этилена полностью окисляется .
Этиленгликоль производится из окиси углерода в странах с большими запасами угля и менее строгими экологическими нормами. Окислительное карбонилирование метанола до диметилоксалата обеспечивает многообещающий подход к производству этиленгликоля на основе C 1 . Диметилоксалат может быть преобразован в этиленгликоль с высокими выходами (94,7%) путем гидрирования с медным катализатором:
Окислительное карбонилирование метанола до диметилоксалата обеспечивает многообещающий подход к производству этиленгликоля на основе C 1 . Диметилоксалат может быть преобразован в этиленгликоль с высокими выходами (94,7%) путем гидрирования с медным катализатором:
Поскольку метанол перерабатывается, потребляются только окись углерода, водород и кислород. Один завод производственной мощностью 200 000 тонн этиленгликоля в год находится во Внутренней Монголии , а второй завод в китайской провинции Хэнань с мощностью 250 000 тонн в год был запланирован на 2012 год. По состоянию на 2015 год, четыре завода в Китае с производительностью 200 000 т / год каждая действовала, и, по крайней мере, еще 17 машин в будущем.
Биологические маршруты
У гусеницы большой восковой моли, Galleria mellonella , есть кишечные бактерии, способные разлагать полиэтилен (PE) до этиленгликоля.
Исторические маршруты
Согласно большинству источников, французский химик Шарль-Адольф Вюрц (1817–1884) впервые получил этиленгликоль в 1856 году. Сначала он обработал «иодид этилена» (C 2 H 4 I 2 ) ацетатом серебра, а затем гидролизовал полученный «диацетат этилена». с гидроксидом калия . Вюрц назвал свое новое соединение «гликоль», потому что он разделяет качества как этилового спирта (с одной гидроксильной группой), так и глицерина (с тремя гидроксильными группами). В 1859 году, Вюрец готовил этиленгликоль через гидратацию из окиси этилена . По всей видимости, до Первой мировой войны этиленгликоль не производился и не применялся в коммерческих целях , когда он был синтезирован из этилендихлорида в Германии и использовался в качестве заменителя глицерина во взрывчатых веществах .
Сначала он обработал «иодид этилена» (C 2 H 4 I 2 ) ацетатом серебра, а затем гидролизовал полученный «диацетат этилена». с гидроксидом калия . Вюрц назвал свое новое соединение «гликоль», потому что он разделяет качества как этилового спирта (с одной гидроксильной группой), так и глицерина (с тремя гидроксильными группами). В 1859 году, Вюрец готовил этиленгликоль через гидратацию из окиси этилена . По всей видимости, до Первой мировой войны этиленгликоль не производился и не применялся в коммерческих целях , когда он был синтезирован из этилендихлорида в Германии и использовался в качестве заменителя глицерина во взрывчатых веществах .
В Соединенных Штатах полукоммерческое производство этиленгликоля через этиленхлоргидрин началось в 1917 году. Первый крупномасштабный промышленный завод по производству гликоля был построен в 1925 году в Южном Чарлстоне, Западная Вирджиния , компанией Carbide and Carbon Chemicals Co. (ныне Union Carbide Corp.) . К 1929 году этиленгликоль использовался почти всеми производителями динамита . В 1937 году компания Carbide запустила первую установку, основанную на процессе Лефорта, для парофазного окисления этилена до окиси этилена. Carbide сохранял монополию на процесс прямого окисления до 1953 года, когда процесс научного проектирования был коммерциализирован и предложен для лицензирования.
(ныне Union Carbide Corp.) . К 1929 году этиленгликоль использовался почти всеми производителями динамита . В 1937 году компания Carbide запустила первую установку, основанную на процессе Лефорта, для парофазного окисления этилена до окиси этилена. Carbide сохранял монополию на процесс прямого окисления до 1953 года, когда процесс научного проектирования был коммерциализирован и предложен для лицензирования.
Использует
Этиленгликоль в основном используется в составах антифризов (50%) и в качестве сырья при производстве полиэфиров, таких как полиэтилентерефталат (ПЭТ) (40%).
Хладагент и теплоноситель
В основном этиленгликоль используется в качестве среды для конвективной теплопередачи , например, в автомобилях и компьютерах с жидкостным охлаждением. Этиленгликоль также обычно используется в качестве охлаждающей жидкости для систем кондиционирования воздуха с охлажденной водой , в которых либо чиллер, либо кондиционеры размещаются снаружи, либо должны охлаждаться ниже температуры замерзания воды. В геотермальных системах отопления / охлаждения этиленгликоль является жидкостью, которая переносит тепло с помощью геотермального теплового насоса . Этиленгликоль либо получает энергию из источника (озеро, океан, колодец ), либо отводит тепло в сток, в зависимости от того, используется ли система для отопления или охлаждения.
В геотермальных системах отопления / охлаждения этиленгликоль является жидкостью, которая переносит тепло с помощью геотермального теплового насоса . Этиленгликоль либо получает энергию из источника (озеро, океан, колодец ), либо отводит тепло в сток, в зависимости от того, используется ли система для отопления или охлаждения.
Чистый этиленгликоль имеет удельную теплоемкость примерно вдвое меньше, чем у воды. Таким образом, обеспечивая защиту от замерзания и повышенную температуру кипения, этиленгликоль снижает удельную теплоемкость водных смесей по сравнению с чистой водой. Смесь в соотношении 1: 1 по массе имеет удельную теплоемкость около 3140 Дж / (кг · ° C) (0,75 БТЕ / (фунт · ° F)), что составляет три четверти от чистой воды, что требует увеличения расхода при одинаковых температурах. система сравнения с водой. Образование больших пузырьков в охлаждающих каналах двигателей внутреннего сгорания будет серьезно препятствовать тепловому потоку (потоку) из области, так что допустить зарождение (крошечные пузырьки) не рекомендуется. Большие пузыри в охлаждающих каналах будут самоподдерживающимися или увеличиваться в размерах, практически полностью потеряв охлаждение в этой области. С чистым MEG (моноэтиленгликоль) горячая точка достигнет 200 ° C (392 ° F). Охлаждение за счет других эффектов, таких как тяга воздуха от вентиляторов (не учитываемая при анализе чистого зародышеобразования), поможет предотвратить образование больших пузырьков.
Большие пузыри в охлаждающих каналах будут самоподдерживающимися или увеличиваться в размерах, практически полностью потеряв охлаждение в этой области. С чистым MEG (моноэтиленгликоль) горячая точка достигнет 200 ° C (392 ° F). Охлаждение за счет других эффектов, таких как тяга воздуха от вентиляторов (не учитываемая при анализе чистого зародышеобразования), поможет предотвратить образование больших пузырьков.
Смесь этиленгликоля с водой обеспечивает дополнительные преимущества для охлаждающих жидкостей и антифризов, такие как предотвращение коррозии и разложения кислоты, а также подавление роста большинства микробов и грибков.
Антифриз
Чистый этиленгликоль замерзает при температуре около -12 ° C (10,4 ° F), но при смешивании с водой смесь замерзает при более низкой температуре. Например, смесь 60% этиленгликоля и 40% воды замерзает при температуре -45 ° C (-49 ° F). Аналогичным образом ведет себя диэтиленгликоль . Понижение температуры замерзания некоторых смесей можно объяснить как коллигативное свойство растворов, но в высококонцентрированных смесях, таких как пример, ожидаются отклонения от поведения идеального раствора из-за влияния межмолекулярных сил .
Соотношение компонентов смеси различается в зависимости от того, этиленгликоль это или пропиленгликоль. Для этиленгликоля пропорции смешивания обычно составляют 30/70 и 35/65, тогда как соотношения смешивания пропиленгликоля обычно составляют 35/65 и 40/60. Важно, чтобы смесь была морозостойкой при минимальной рабочей температуре.
Из — за депрессивные температурами замерзания, этиленгликоль используется в качестве антиобледенительной жидкости для ветровых стекол и воздушных суден, в качестве антифриза в автомобильных двигателях, а также как компонент витрификации (антикристаллизационные) смеси для сохранения низкотемпературного биологических тканей и органов. Смесь этиленгликоля и воды также может быть химически обозначена как концентрат гликоля / соединение / смесь / раствор.
Использование этиленгликоля не только снижает температуру замерзания водных смесей, но и повышает их температуру кипения. Это приводит к расширению диапазона рабочих температур для жидких теплоносителей на обоих концах температурной шкалы. Повышение температуры кипения связано с тем, что чистый этиленгликоль имеет гораздо более высокую температуру кипения и более низкое давление пара, чем чистая вода, что типично для большинства бинарных смесей летучих жидкостей .
Повышение температуры кипения связано с тем, что чистый этиленгликоль имеет гораздо более высокую температуру кипения и более низкое давление пара, чем чистая вода, что типично для большинства бинарных смесей летучих жидкостей .
Прекурсор полимеров
В пластмассовой промышленности этиленгликоль является важным предшественником полиэфирных волокон и смол . Полиэтилентерефталат , используемый для изготовления пластиковых бутылок для безалкогольных напитков , получают из этиленгликоля.
Этиленгликоль является одним из предшественников полиэтилентерефталата , который ежегодно производится в многомиллионных тоннах.Другое использование
Дегидратирующий агент
Этиленгликоль используется в газовой промышленности для удаления водяного пара из природного газа перед его дальнейшей обработкой, почти так же, как триэтиленгликоль (ТЭГ).
Ингибирование гидратов
Благодаря высокой температуре кипения и сродству к воде этиленгликоль является полезным осушителем . Этиленгликоль широко используется для подавления образования клатратов (гидратов) природного газа в длинных многофазных трубопроводах, по которым природный газ транспортируется с удаленных газовых месторождений на газоперерабатывающий завод. Этиленгликоль можно выделить из природного газа и повторно использовать в качестве ингибитора после очистки, удаляющей воду и неорганические соли.
Этиленгликоль широко используется для подавления образования клатратов (гидратов) природного газа в длинных многофазных трубопроводах, по которым природный газ транспортируется с удаленных газовых месторождений на газоперерабатывающий завод. Этиленгликоль можно выделить из природного газа и повторно использовать в качестве ингибитора после очистки, удаляющей воду и неорганические соли.
Природный газ обезвоживается этиленгликолем. В этом случае этиленгликоль стекает с верха колонны и встречает поднимающуюся смесь водяного пара и углеводородных газов. Сухой газ выходит из верхней части башни. Гликоль и вода разделяются, а гликоль используется повторно. Вместо удаления воды можно также использовать этиленгликоль для снижения температуры, при которой образуются гидраты . Чистота гликоля, используемого для подавления гидратов (моноэтиленгликоль), обычно составляет около 80%, тогда как чистота гликоля, используемого для дегидратации (триэтиленгликоль), обычно составляет от 95 до более чем 99%. Более того, скорость закачки для подавления гидратов намного ниже, чем скорость циркуляции в башне дегидратации гликоля.
Более того, скорость закачки для подавления гидратов намного ниже, чем скорость циркуляции в башне дегидратации гликоля.
Приложения
Незначительное использование этиленгликоля включает производство конденсаторов, в качестве промежуточного химического соединения при производстве 1,4-диоксана , в качестве добавки для предотвращения коррозии в системах жидкостного охлаждения для персональных компьютеров и внутри линзовых устройств типа электронно-лучевой трубки. проекционных телевизоров. Этиленгликоль также используется при производстве некоторых вакцин , но сам по себе не присутствует в этих инъекциях. Он используется как второстепенный (1-2%) ингредиент в креме для обуви, а также в некоторых чернилах и красителях. Этиленгликоль несколько раз применялся в качестве средства для лечения гнили и грибка древесины, как в качестве профилактики, так и в качестве лечения постфактум. В некоторых случаях он использовался для обработки частично сгнивших деревянных предметов для выставок в музеях. Это одно из немногих средств, которые успешно справляются с гниением деревянных лодок и относительно дешевы. Этиленгликоль также может быть одним из второстепенных ингредиентов в растворах для очистки экрана, наряду с основным ингредиентом изопропиловым спиртом . Этиленгликоль обычно используется в качестве консерванта для биологических образцов, особенно в средних школах во время вскрытия, как более безопасная альтернатива формальдегиду . Он также используется в составе гидравлической жидкости на водной основе, используемой для управления подводным оборудованием для добычи нефти и газа.
Это одно из немногих средств, которые успешно справляются с гниением деревянных лодок и относительно дешевы. Этиленгликоль также может быть одним из второстепенных ингредиентов в растворах для очистки экрана, наряду с основным ингредиентом изопропиловым спиртом . Этиленгликоль обычно используется в качестве консерванта для биологических образцов, особенно в средних школах во время вскрытия, как более безопасная альтернатива формальдегиду . Он также используется в составе гидравлической жидкости на водной основе, используемой для управления подводным оборудованием для добычи нефти и газа.
Этиленгликоль используется в качестве защитной группы в органическом синтезе для защиты карбонильных соединений, таких как кетоны и альдегиды.
Кремний вступает в реакцию диоксида в нагретом с обратным холодильником при диазоте с этиленгликолем и щелочным металлом , основанием для получения высокого реакционной способности , пентакоординированный силикаты , которые обеспечивают доступ к широкому спектру новых соединений кремния. Силикаты практически нерастворимы во всех полярных растворителях, кроме метанола.
Силикаты практически нерастворимы во всех полярных растворителях, кроме метанола.
Его также можно использовать при производстве вакцин или в качестве заменителя формальдегида при хранении биологических образцов.
Химические реакции
Этиленгликоль используется в качестве защитной группы для карбонильных групп в органическом синтезе . Обработка кетона или альдегида этиленгликолем в присутствии кислотного катализатора (например, п-толуолсульфоновой кислоты ; BF 3 · Et 2 O ) дает соответствующий 1,3- диоксолан , устойчивый к основаниям и другим нуклеофилам. После этого защитную группу 1,3-диоксолана можно удалить путем дальнейшего кислотного гидролиза . В этом примере изофорон был защищен с помощью этиленгликоля п-толуолсульфоновой кислотой с умеренным выходом. Воду удаляли азеотропной перегонкой, чтобы сместить равновесие вправо.
Токсичность
Этиленгликоль умеренно токсичен, с пероральным LD Lo = 786 мг / кг для человека. Основная опасность заключается в его сладком вкусе, который может привлечь детей и животных. При приеме внутрь этиленгликоль окисляется до гликолевой кислоты , которая, в свою очередь, окисляется до токсичной щавелевой кислоты . Он и его токсичные побочные продукты сначала поражают центральную нервную систему , затем сердце и, наконец, почки. При отсутствии лечения проглатывание в достаточном количестве приводит к летальному исходу. Только в США ежегодно регистрируется несколько смертей.
Основная опасность заключается в его сладком вкусе, который может привлечь детей и животных. При приеме внутрь этиленгликоль окисляется до гликолевой кислоты , которая, в свою очередь, окисляется до токсичной щавелевой кислоты . Он и его токсичные побочные продукты сначала поражают центральную нервную систему , затем сердце и, наконец, почки. При отсутствии лечения проглатывание в достаточном количестве приводит к летальному исходу. Только в США ежегодно регистрируется несколько смертей.
Доступны антифризы для автомобилей, содержащие пропиленгликоль вместо этиленгликоля. Обычно они считаются более безопасными в использовании, поскольку пропиленгликоль не такой вкусный и превращается в организме в молочную кислоту , нормальный продукт метаболизма и физических упражнений.
Австралия, Великобритания и семнадцать штатов США (по состоянию на 2012 год) требуют добавления горького вкуса ( бензоат денатония ) к антифризу. В декабре 2012 года производители антифризов США добровольно согласились добавлять горький ароматизатор во все антифризы, продаваемые на потребительском рынке США.
Экологические последствия
Этиленгликоль — химическое вещество, производимое в больших объемах ; он распадается на воздухе примерно за 10 дней, а в воде или почве — за несколько недель. Он попадает в окружающую среду за счет рассеивания продуктов, содержащих этиленгликоль, особенно в аэропортах, где он используется в противообледенительных средствах для взлетно-посадочных полос и самолетов. В то время как пролонгированные низкие дозы этиленгликоля не проявляют токсичности, в дозах, близких к летальным (≥ 1000 мг / кг в день), этиленгликоль действует как тератоген . «Основываясь на довольно обширной базе данных, он вызывает изменения скелета и пороки развития у крыс и мышей при всех путях воздействия». Эта молекула наблюдалась в космосе.
Ноты
Рекомендации
внешние ссылки
Технические условия морской перевозки этиленгликоля наливом – РТС-тендер
МИНИСТЕРСТВО МОРСКОГО ФЛОТА
7-М
ОБЩИЕ
И
СПЕЦИАЛЬНЫЕ ПРАВИЛА
ПЕРЕВОЗКИ НАЛИВНЫХ ГРУЗОВ
ЧАСТЬ III
ТЕХНИЧЕСКИЕ УСЛОВИЯ МОРСКОЙ
ПЕРЕВОЗКИ
(ТУМП) НАЛИВНЫХ ГРУЗОВ
ТЕХНИЧЕСКИЕ УСЛОВИЯ
МОРСКОЙ ПЕРЕВОЗКИ ЭТИЛЕНГЛИКОЛЯ НАЛИВОМ
РД 31. 11.81.13-78.
11.81.13-78.
МОСКВА
В/О «МОРТЕХИНФОРМРЕКЛАМА»
1985
Разработаны Центральным научно-исследовательским институтом морского флота (ЦНИИМФ)
Черноморский филиал
Директор филиала Л. Д. Яловой
Руководитель темы И. П. Горяинов
Ответственные исполнители: В.А. Бобыр, Н.И. Вивденко, Н.В. Васин, М.П. Зинько, И.П. Корниенко, О.К. Кепинг, Т.В. Кузнецова, А.Ш. Кушнир, Н.И. Коваленко, В.В. Луговенко, И.Г. Потапов, Н.И. Плявин, Я.Н. Спиридонов, В.Н. Татаренко
Согласованы Главным управлением перевозок, эксплуатации флота и портов Минморфлота
Начальник В.С. Збаращенко
Внесены Главным управлением перевозок, эксплуатации флота и портов Минморфлота
Начальник В.С. Збаращенко
ТЕХНИЧЕСКИЕ УСЛОВИЯ МОРСКОЙ ПЕРЕВОЗКИ ЭТИЛЕНГЛИКОЛЯ НАЛИВОМ
РД 31. 11.81.13-78
11.81.13-78
Перевозка этиленгликоля наливом допускается на судах, удовлетворяющих требованиям Правил классификации и постройки судов Регистра СССР.
ИНФОРМАЦИОННАЯ КАРТА
№ ООН —
Стр. ИМО —
Группа МОПОГ 9115
1.1. Наименование: этиленгликоль.
1.2. Синонимы: гликоль этилена, дигидрокенэтан, этандиоль, 1-2-этандиоль, этиленовый спирт, моноэтиленовый гликоль.
1.3. На английском языке: ETHYLENEGLYCOL.
1.4. Квалификация химического продукта: технический продукт.
1.5. Химическая формула: СН2ОН-СН2ОН.
1.6. Химическая группа: спирты.
1.7. Внешний вид: бесцветная немного вязкая жидкость.
1.8. Запах: очень слабый.
1.9. Основная опасность: токсичность при проглатывании.
2.1. Относительная молекулярная масса 62
2. 2.
Плотность при 20 °С, кг/м3 1116
2.
Плотность при 20 °С, кг/м3 1116
2.3. Температура кипения, °С 197,6
2.4. Температура затвердевания, °С -15,6
2.5. Вязкость при 20 °С, сП 20,9
2.6. Растворимость в воде, масс. % Неограниченная
2.7. Парциальное давление паров в воздухе при 20 °С, Па 7,98
2.8. Коэффициент объемного расширения при 20 °С, 1/к 0,00062
2.9. Плотность пара по отношению к воздуху 2,14
2.10. Удельное объемное электрическое сопротивление, Ом·м 0,5·105
2.11. Термочувствительность:
морозочувствителен.
2.12. Чувствительность к посторонним запахам: очень чувствителен.
2.13. Влагочувствительность: гигроскопичен.
3.1. Отношение к воздуху: боится атмосферной влаги.
3.2. Отношение к воде: очень гигроскопичен.
3.3. Отношение к морской воде: очень гигроскопичен.
3.4. Взаимодействие с классами химических веществ: взаимодействует с окислителями; при действии водоотнимающих веществ (H2SO4, ZnCl2) образуется уксусный альдегид.
3.5. Взаимодействие с материалами конструкций: для перевозки этиленгликоля пригодны конструкции из мягкой стали, нержавеющей стали, алюминия.
3.6. Совместимость: несовместим с сильными окислителями.
3.7. Устойчивость: устойчив при рекомендуемом режиме перевозки.
4.1. Категория опасности по Правилам Регистра СССР 3
4.2. Температура вспышки, °С 116
4. 3.
Температура самовоспламенения, °С 432
3.
Температура самовоспламенения, °С 432
4.4. Концентрационные пределы взрываемости газов и паров, % 3,2 — 6,4
4.5. Образование токсичных продуктов при сгорании: образование сажи, угарного и углекислого газов, азота.
4.6. Средства тушения пожара.
4.6.1. Рекомендуемые огнегасительные средства: тонкораспыленная вода, высокократная пена, среднекратная пена, двуокись углерода, состав «3, 5».
5.1. Общая характеристика: при попадании в организм через рот вызывает острое отравление, действует на сосуды, почки, нервную систему, вызывает отек, набухание и некроз сосудов. Не представляет опасности острых отравлений в результате вдыхания паров.
5.2. Класс опасности………………………………………………………………………. 4
5.3. Предельно допустимая концентрация паров в воздухе (ПДК), мг/м3 Не установлено
5. 4.
Летальная доза (ЛД50), мг/кг…………………………………………………….. 6610
4.
Летальная доза (ЛД50), мг/кг…………………………………………………….. 6610
5.5. Летальная концентрация (ЛК50), мг/м3……………………………………… Нет данных
5.6. Температурный порог токсичности (ТПТ), °С………………………….. Нет данных
5.7. Меры первой помощи при воздействии паров на:
5.7.1. Дыхательные пути: вывести пострадавшего на свежий воздух. Если дыхание остановилось или слабое, сделать искусственное дыхание по способу «рот в рот» или «рот в нос».
5.7.2. Глаза: не оказывает воздействия.
5.7.3. Кожу: не оказывает воздействия.
5.8. При воздействии жидкости на:
5.8.1. Глаза: осторожно промыть глаза большим количеством чистой морской или пресной воды (промывать не менее 15 мин).
5.8.2. Кожу: снять грязную одежду и хорошо промыть водой.
5.9. Средства индивидуальной
защиты: респираторы типа «Лепесток», «Астра-2» или противогаз с фильтром.
5.10. При попадании жидкости внутрь вызвать рвоту, обильно промыть желудок водой или насыщенным раствором соды, сделать сифонную клизму. Для борьбы с ацидозом — щелочная терапия: обильное питье боржома, 5 %-ного раствора соды. Покой, согревание тела. В более тяжелых случаях — кровопускание (300 — 500 мл) с последующим введением глюкозы и соды или переливанием крови.
6.1. Перевозка в инертной среде: не требуется.
6.2. Ингибирование: не требуется.
6.3. Температурный режим: температура окружающей среды.
6.4. Давление: атмосферное.
6.5. Погрузка «через верх»: не разрешается.
6.6. Скорость налива: на первом этапе погрузки до полного закрытия днищевого набора скорость движения груза в трубопроводе допускается до 1 м/с; на последующих этапах — в зависимости от технического состояния судна и береговых устройств.
7.1. Меры при разливе: смыть водой.
8.1. Категория загрязнения
для эксплуатационного сброса — D.
9.1. Подготовка емкостей под перевозку этиленгликоля должна производиться в соответствии с требованиями § 5 Правил морской перевозки химических грузов наливом.
9.2. Последние три рейса перед перевозкой этиленгликоля должны быть выполнены с такими грузами, как ароматические вещества, спирты, растворители и т.п.
9.3. Зачистные и моечные операции должны выполняться согласно шифрам таблицы (см. Правила морской перевозки химических грузов наливом).
|
№ п/п |
Слитый груз |
Группа груза |
Шифры зачистных и моечных операций |
|
1 |
Ацетон |
14 |
М15АБВ |
|
2 |
Бутанол |
11 |
М1М18АБВ |
|
3 |
Бутилацетат |
16 |
М1М18АБВ |
|
4 |
Бензол |
9 |
М7АБВ |
|
5 |
Дихлорэтан |
10 |
М1М24М18АБВ |
|
6 |
Изобутанол |
11 |
М1М18АБВ |
|
7 |
Изопропилбензол |
9 |
М7АБВ |
|
8 |
Ксилолы (О. |
9 |
М7АБВ |
|
9 |
Каменноугольное масло |
21 |
М2М32М11ЖМ16АБВ |
|
10 |
Метанол |
11 |
М15БВ |
|
11 |
Метилэтилкетон |
14 |
М15АБВ |
|
12 |
Монохлорбензол |
10 |
М19АБВ |
|
13 |
Нитрил акриловой кислоты |
8 |
М1М13М14АБВ |
|
14 |
Стирол |
9 |
БРБМ2М23ГАГБВ |
|
15 |
Серная кислота |
1 |
М1М34М18БВ |
|
16 |
Суперфосфорная кислота |
1 |
М14АБВ |
|
17 |
Талловое масло |
21 |
М9М24М15ЕМ17БВ |
|
18 |
Уксусная кислота |
15 |
М14АБВ |
|
19 |
Формалин |
13 |
М18АБВ |
|
20 |
Фурфурол |
13 |
М2М31М6ЕМ18БВ |
|
21 |
Циклогексан |
7 |
М1М31М18АБВ |
|
22 |
Этиленгликоль |
11 |
Дегазация воздухом |
9. 4. Перед погрузкой этиленгликоля танки должны быть тщательно зачищены
от ржавчины и других веществ (песок и т.п.).
4. Перед погрузкой этиленгликоля танки должны быть тщательно зачищены
от ржавчины и других веществ (песок и т.п.).
9.5. Наличие морской воды в грузовых емкостях не допускается
9.6. Последнюю моечную операцию перед зачисткой проводить пресной водой.
СОДЕРЖАНИЕ
ICSC 0270 — ЭТИЛЕНГЛИКОЛЬ
ICSC 0270 — ЭТИЛЕНГЛИКОЛЬ| ЭТИЛЕНГЛИКОЛЬ | ICSC: 0270 |
| 1,2-этандиол 1,2-дигидроксиэтан 2-гидроксиэтанол Гликоль Гликолевый спирт Этиленовый спирт Моноэтиленгликоль | Май 2018 |
| Номер CAS: 107-21-1 | |
| Номер ЕС: 203-473-3 |
| ОСТРАЯ ОПАСНОСТЬ | ПРОФИЛАКТИКА | ПОЖАРНАЯ ТУШЕНИЕ | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючие. | НЕТ открытого огня. | Используйте водную пыль, порошок, спиртоустойчивую пену, двуокись углерода. |
| ПРЕДОТВРАТИТЬ ОБРАЗОВАНИЕ ТУМАНОВ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИКА | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Головокружение. Головная боль. | Использовать вентиляцию. | Свежий воздух, отдых. Обратитесь за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. Боль. | Надевайте защитные очки. | Сначала промойте большим количеством воды в течение нескольких минут (снимите контактные линзы, если это легко возможно), затем обратитесь за медицинской помощью. |
| Проглатывание | Боль в горле.Тошнота. Рвота. Боль в животе. Сонливость. Бессознательное состояние. | Не ешьте, не пейте и не курите во время работы. | Прополоскать рот. Не вызывает рвоту. Немедленно обратитесь за медицинской помощью. |
| УТИЛИЗАЦИЯ РАЗЛИВОВ | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Персональная защита: респиратор с фильтром для органических газов и паров, адаптированный к концентрации вещества в воздухе.По возможности собрать подтекающую и пролитую жидкость в герметичные контейнеры. Смойте остаток большим количеством воды. | Согласно критериям СГС ООН ПРЕДУПРЕЖДЕНИЕ Вреден при проглатыванииМожет вызвать повреждение почек и центральной нервной системы Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от сильных окислителей, сильных оснований и сильных кислот. Сухой. Вентиляция по полу. Сухой. Вентиляция по полу. | |
| УПАКОВКА | |
Подготовлено международной группой экспертов от имени МОТ и ВОЗ,
при финансовой поддержке Европейской комиссии. |
| ЭТИЛЕНГЛИКОЛЬ | ICSC: 0270 |
| ФИЗИКО-ХИМИЧЕСКАЯ ИНФОРМАЦИЯ | |
|---|---|
Физическое состояние; Внешний вид Физическая опасность Химическая опасность | Формула: HOCH 2 CH 2 OH |
| ВОЗДЕЙСТВИЕ И ВЛИЯНИЕ НА ЗДОРОВЬЕ | |
|---|---|
Пути воздействия Эффекты краткосрочного воздействия | Риск при вдыхании Последствия длительного или многократного воздействия |
| ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ НА ПРОФЕССИОНАЛЬНОЙ РАБОТЕ |
|---|
| TLV: (пар и аэрозоль): 25 ppm как TWA. TLV: (пар): 50 частей на миллион для STEL. TLV: (аэрозоль для ингаляции): 10 мг / м 3 как STEL.  A4 (не классифицируется как канцероген для человека). EU-OEL: 52 мг / м 3 как TWA; 104 мг / м 3 как СТЭЛ; (кожа) |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Воздействие вещества на окружающую среду было должным образом исследовано, но никаких значительных эффектов обнаружено не было. |
| ПРИМЕЧАНИЯ |
|---|
| При отравлении этим веществом необходимо специальное лечение; должны быть доступны соответствующие средства с инструкциями. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |
Все права защищены. Опубликованные материалы распространяются без каких-либо явных или подразумеваемых гарантий. Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. Ни МОТ, ни ВОЗ, ни Европейская комиссия не несут ответственности за интерпретацию и использование информации, содержащейся в этом материале. | |
Смотрите также:
Токсикологические сокращения
Этиленгликоль (PIM 227)
Этиленгликоль (PIM 227F, французский)
Этиленгликоль — молекула месяца
Этиленгликоль — молекула месяца — июнь 2018 г. (HTML-версия)Это же антифриз, не так ли?
Да, это одно из основных применений этиленгликоля (второе — производство полимеров).
Почему этиленгликоль используется в антифризах?
Понижает точку замерзания воды (и повышает точку кипения), а также смешивается с водой во всех пропорциях. И это связано со свойствами молекулы, особенно с ее способностью образовывать водородные связи.
Почему? Во-первых, этиленгликоль содержит полярные группы O-H; они полярны, потому что кислород намного более электроотрицателен, чем водород, поэтому он имеет тенденцию поляризовать электронную пару в связи O-H по отношению к нему. |
|
Водородная связь в этиленгликоле.
Поскольку этиленгликоль имеет две группы –ОН, обе из которых могут образовывать водородные связи, по сравнению с одной в другой двухуглеродной молекуле, этаноле («спирте»), вот почему температура кипения этиленгликоля довольно высока. выше, чем у этанола.
| Этиленгликоль | Этанол |
Увеличенное количество водородных связей в этиленгликоле делает его более вязким (менее текучим), чем этанол (или вода).
Вода также, конечно же, содержит группы O-H, которые «связывают водородные связи» друг с другом, в результате чего вода имеет очень высокую температуру кипения для молекулы такого размера. Таким образом, молекулы этиленгликоля и воды могут образовывать водородные связи друг с другом, как и отдельные молекулы, что означает, что они свободно смешиваются во всех пропорциях, как показано на диаграмме ниже.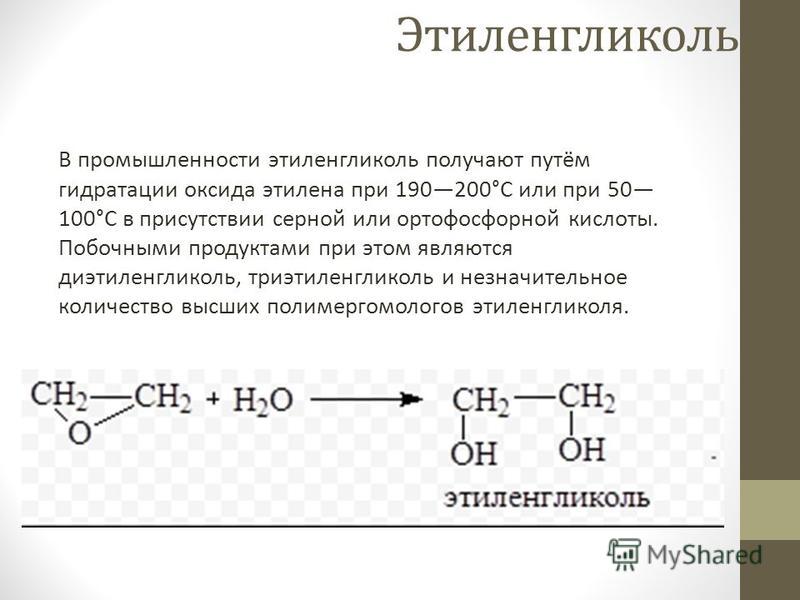
Как это помогает с антифризом?
Ну, этиленгликоль мешает сети водородных связей в чистой воде.Вода замерзает при 0 ° C, а чистый этиленгликоль при -12 ° C, но смесь этих двух веществ замерзает при гораздо более низкой температуре — самой низкой температуре кипения. достигается -55 ° C в смесях, содержащих 70% этиленгликоля. Это означает, что если такую смесь использовать в системе охлаждения автомобиля, она не затвердеет даже при очень низких зимних температурах. Это свойство также используется в противообледенительной жидкости на лобовых стеклах или внешних поверхностях самолетов.
Как сделать этиленгликоль?
Обычно маршруты начинаются с этена (MOTM, декабрь 2006 г.).Впервые об этом сообщил в 1856 году Адольф Вюрц (изображение справа), французский химик из Эльзаса.
Эльзасец, вы имеете в виду, что он лаял?
Очень далеко от этого. Нет, он приехал из Эльзаса; вот почему в Страсбурге стоит его памятник. Он был большим сторонником теории атома. Во всяком случае, вернемся к гликолю. Он прореагировал 1,2-дийодэтан (косвенно полученный из этена) в реакции этерификации с этаноатом серебра (ацетатом), что также является реакцией нуклеофильного замещения.Затем полученный сложный эфир гидролизовали гидроксидом калия.
Он был большим сторонником теории атома. Во всяком случае, вернемся к гликолю. Он прореагировал 1,2-дийодэтан (косвенно полученный из этена) в реакции этерификации с этаноатом серебра (ацетатом), что также является реакцией нуклеофильного замещения.Затем полученный сложный эфир гидролизовали гидроксидом калия.
В настоящее время в промышленном производстве используются процессы, включающие гидратацию этиленоксида, легкодоступного химического вещества, получаемого из этена, в свою очередь получаемого крекингом алканов. Этот процесс восходит к открытию, о котором Вюрц сообщил в 1859 году.
А он пригодится при изготовлении полимеров?
Да, он используется в качестве одного из двух исходных материалов, используемых при производстве полиэтилентерефталата (ПЭТ, a.к.а. Дакрон и Терилен , символ переработки «1»). Двухосновная терефталевая кислота (бензол-1,4-дикарбоновая кислота) реагирует с диолэтиленгликолем, образуя сложный полиэфир.
Имеет множество применений, одно из которых — изготовление пластиковых бутылок для безалкогольных напитков (которые могут использоваться для неправильного хранения антифриза). Другие включают изоляцию и упаковку; веревки; ковры и одежда.
А прочее?
Ежегодно производится более 20 миллионов метрических тонн этиленгликоля.Его можно преобразовать в несколько других полезных химикатов, таких как глиоксаль, гликолевая кислота и метилгликолят, и другие применения продолжают развиваться, включая синтез наноматериалов.
Есть ли обратная сторона этиленгликоля?
Во-первых, он токсичен.
Почему?
В печени фермент алкогольдегидрогеназа превращает этиленгликоль сначала в гликоальдегид, а затем в другие токсичные молекулы. В конечном итоге щавелевая кислота выводит кальций из организма в виде нерастворимого оксалата кальция, который откладывается в почках и повреждает их, что приводит к почечной недостаточности. Также образуется метановая (муравьиная) кислота, которая может вызвать слепоту.
Также образуется метановая (муравьиная) кислота, которая может вызвать слепоту.
Кто особенно подвержен риску?
Поскольку антифриз — это обычное химическое вещество, некоторые люди небрежно обращаются с ним по дому. Они хранят его в контейнерах, предназначенных для других вещей, например, в контейнерах, предназначенных для напитков, и не имеют надлежащей маркировки. Люди оставляют его на гаражных полках, где его могут найти дети. Разливы не всегда устраняются. Это означает, что особенно подвержены риску домашние животные и маленькие дети.Одна или несколько ложек может быть смертельной для кошки или маленькой собаки. Смертельная доза для взрослого человека составляет около 120 граммов. Антифриз обычно ярко окрашен, а этиленгликоль придает ему сладкий вкус, что делает его привлекательным для молодежи. В некоторых местах к нему добавляют горькое вещество, такое как бензоат денатония, чтобы отпугнуть людей, но некоторые исследования показали, что это не приносит успеха.
Так можно кого-нибудь антифризом отравиться?
Не говоря уже об отравлении, существует целый список людей, убитых антифризом.В 2007 году американка по имени Линн Тернер (на фото слева) была признана виновной в убийстве в 2001 году ее парня, полицейского Рэнди Томпсона, путем заливки антифриза в его желе. Таким же образом в 1995 году она убила своего тогдашнего мужа, пожарного Мориса Гленна Тернера. Тернер была приговорена к пожизненному заключению и умерла в тюрьме в 2011 году от передозировки прописанных ей лекарств. В 2007 году женщина из Нью-Джерси по имени Мэриэнн Нибор была приговорена к 20 годам лишения свободы за убийство своего зятя, добавив этиленгликоль в свой коктейль из ананасового сока и вишни мараскино и приготовив «коктейль с антифризом».В январе 2008 года женщина из Сток-он-Трент (Великобритания) по имени Кейт Найт была признана виновной в попытке убить своего мужа Ли, добавив антифриз в его карри и красное вино, и приговорена к 30 годам лишения свободы. Хотя он выжил, у Ли была серьезная потеря зрения и слуха, а также сильно повреждены почки. Впоследствии он нашел любовь к медсестре по диализу Джеки Эванс, которая лечила его, и снова женился. В том же году Джеймс Кеун из Уолтэма, штат Массачусетс, был признан виновным в убийстве первой степени за то, что зашнуровал свою жену Джулис Гаторэйд антифризом.
Хотя он выжил, у Ли была серьезная потеря зрения и слуха, а также сильно повреждены почки. Впоследствии он нашел любовь к медсестре по диализу Джеки Эванс, которая лечила его, и снова женился. В том же году Джеймс Кеун из Уолтэма, штат Массачусетс, был признан виновным в убийстве первой степени за то, что зашнуровал свою жену Джулис Гаторэйд антифризом.
Затем в 2013 году онколог, специализирующийся на раке груди, доктор Ана Мария Гонсалес-Ангуло (фото справа), работавшая в онкологическом центре в Хьюстоне, штат Техас, добавила кофе своему возлюбленному доктору Джорджу Блюменшайну (легкие, голова и шея). онколог) с антифризом. Он прокомментировал сладкий вкус, но ему сказали, что это Splenda . Он выжил с повреждением почек. За нападение при отягчающих обстоятельствах она получила 10-летний срок. В 2016 году Дайан Стаудт и ее дочь Рэйчел из Спрингфилда, штат Миссури, были приговорены к пожизненному заключению после признания в убийстве сначала своего мужа Марка, а затем своего сына Шона антифризом. Затем по той же причине серьезно заболела ее старшая дочь Сара, но выжила.
Затем по той же причине серьезно заболела ее старшая дочь Сара, но выжила.
Но следует помнить, что эти преступления очень редки; просто они, как правило, ловят заголовки. А пострадавшие расслабляются с антифризом. Постоянно.
Вы забыли чехол Cherry Lambrini
Ах да, спасибо. В 2013 году Жаклин Патрик добавила антифриз в напиток Cherry Lambrini своего мужа-водителя лондонского автобуса Дугласа на Рождество; она и ее дочь Кэтрин получили в общей сложности 18 лет лишения свободы.Ее поймали из-за орфографической ошибки («dignaty») в фальшивой предсмертной записке.
Разве я не видел что-нибудь об отравлении антифризом в «Побеге из тюрьмы»?
Да, в недавнем эпизоде сериала «Побег из тюрьмы» (сезон 5, эпизод 6, показан в мае 2017 года, если быть точным!), Главный герой Майкл Шофилд застрял в пустыне с джипом, но без воды, и около 20 миль пешком до безопасного места. И что еще хуже, он был ранен в ногу ножом, зараженным антифризом. Он благополучно добрался до дома, но ему потребовалась неотложная медицинская помощь от отравления, в том числе переливание крови!
Он благополучно добрался до дома, но ему потребовалась неотложная медицинская помощь от отравления, в том числе переливание крови!
Это единственное противоядие от отравления этиленгликолем?
Если врачи достаточно рано диагностируют отравление этиленгликолем, они могут назначить противоядие, например этанол. Он связывается с ферментом алкогольдегидрогеназа в печени примерно в 100 раз сильнее, чем этиленгликоль, так что, предотвращая прикрепление этиленгликоля к печени, почки имеют возможность вывести этиленгликоль в неизмененном виде и безвредно удалить его из организма. тело.Фомепизол (название которого происходит от химического названия 4-метилпиразол) является новым противоядием и действует так же, как этанол.
| Фомепизол |
Есть ли другие спирты, которые ведут себя аналогичным образом?
В антифризах обычно используются три разные молекулы: этиленгликоль, диэтиленгликоль (ДЭГ) и пропиленгликоль, особенно первая, которая вызывает большинство отравлений, случайных или иных.
| Этиленгликоль | Диэтиленгликоль (ДЭГ) | Пропиленгликоль |
Пропиленгликоль гораздо менее токсичен, но диэтиленгликоль был причастен к целому ряду отравлений. Как и этиленгликоль, он имеет очень высокую температуру кипения (244 ° C). Самый известный случай отравления диэтиленгликолем произошел в сентябре-октябре 1937 года, когда американская фармацевтическая компания хотела продать сульфаниламид (MOTM, июль 2011), чудесный, но несколько нерастворимый антибиотик в жидкой форме.Их главный химик Гарольд Уоткинс обнаружил, что ДЭГ был очень хорошим растворителем для сульфаниламида. Он добавил красный цвет и аромат малины, и компания продавала его по США. К сожалению, он не проводил тестов на токсичность. Около сотни человек, многие из которых были детьми, умерли, прежде чем об этом стало известно. Уоткинс покончил жизнь самоубийством. Это привело к принятию Федерального закона о пищевых продуктах, лекарствах и косметических средствах 1938 года, который предоставил FDA право тестировать все новые лекарства, а 25 лет спустя этот закон запретил использование талидомида (MOTM, июль 2000 года) в США.
Статья из New York Times за 1985 год об австрийском винном скандале.
В 1985 году винную промышленность Австрии охватил скандал. Было обнаружено, что некоторые производители вина добавляли DEG в свои сладкие белые вина, чтобы они казались более сладкими, более похожими на Prädikatswein позднего урожая. Поскольку концентрации DEG были низкими, человеческих жертв не было, хотя винодельческая промышленность Австрии получила почти смертельный удар. В 1996 году 85 гаитянских детей умерли от фальсифицированного сиропа от кашля, содержащего ДЭГ, и эта же комбинация отравила более 300 детей в Бангладеш. Отхаркивающее средство, содержащее ДЭГ, было обвинено в смерти примерно 30 индийских детей в 1998 году. Другие случаи заболевания были зарегистрированы из таких стран, как Панама, Южная Африка, Нигерия и Аргентина. Еще в 2007 году были проблемы с некоторыми зубными пастами, импортируемыми из Китая, которые, как выяснилось, содержали DEG. С другой стороны, другой триол, глицерин (MOTM, январь 2018 г.), совсем не токсичен, поскольку необходим для функционирования человеческого организма. | У Эрнесто Осорио из Панамы было частично парализовано лицо после употребления сиропа от кашля, загрязненного ДЭГ. Фото: Анхель Франко / The New York Times |
| Глицерин Пропан-1,2,3-триол |
Небольшие изменения в структуре могут иметь большое значение для токсичности — просто подумайте о разнице между этанолом и гораздо более токсичным метанолом.
Библиография
- Объединенный химический словарь Чапмена и Холла Кодовый номер CTX90-I (этиленгликоль) и BGL75-B (диэтиленгликоль).
- A. Wurtz, «Sur le glycol or alcool diatomique», Comptes Rendus , 1856, 43 , 199-204 (открытие)
- A. Wurtz, «Synthèse du glycol avec l’oxyde d’éthylène et l’eau» Comptes rendus , 1859, 49 , 813–815.
- http://www.prepchem.com/synthesis-of-ethylene-glycol/ (лабораторный синтез)
- H. Yue, Y. Zhao, X. Ma и J. Gong, Chem. Soc. Ред. , 2012, 41 , 4218–4244 (обзор этиленгликоля)
- MA Jobson, SL Hogan, CS Maxwell, Y. Hu, GA Hladik, RJ Falk, MC Beuhler и WF Pendergraft, PLoS ONE , 2015, 10 , e0143044 (воздействие этиленгликоля в США и влияние горького добавки)
- К.Донг, С. Элангован, Р. Санг, А. Спанненберг, Р. Джекстелл, К. Юнге, Ю. Ли и М. Беллер, Nature Communications , 2016, 7 , 12075 (двухступенчатый синтез из CO)
- http://www.
 petresin.org/news_introtoPET.asp (информационный бюллетень по полиэтилентерефталату)
petresin.org/news_introtoPET.asp (информационный бюллетень по полиэтилентерефталату)
Случаи отравления
- J. A. Vale, B. Widdop и N. H. Bluett, Postgrad. Med. J. , 1976, 52 , 598-602 (отравление этиленгликолем у ребенка)
- А.Д. Уолдер и К. К. Г. Тайлер, Анестезия , 1994, 49 , 964-967 (3 случая отравления антифризом)
- I. Tennant, A. Crawford-Sykes, L. Ward и C. Thesiger, West Indian Med. J. , 2006, 55 , 286-287 (отравление после проглатывания тормозной жидкости)
- Б. В. Морган, Р. Дж. Геллер и З. Н. Каззи, West. J. Emerg. Med. , 2011, 12 , 296-299 (дело Линн Тернер и увеличение случаев умышленного отравления)
- Дж.Latus, M. Kimmel, M. D. Alscher и N. Braun, Clin. Kidney J. 2012, 5 , 120–123 (шесть случаев отравления этиленгликолем)
- Дело Линн Тернер
- Дело Джеймса Кеуна
- Дело Мэрианн Небор
- Чехол Lee Knight
- Дело Аны Марии Гонсалес – Ангуло
- Чехол Diane Staudte
Отравление Черри Ламбрини
Антидоты фомепизола и этанола
- Дж.
 Brent, Drugs , 2001, 61 , 979-988 (Управление отравлением этиленгликолем)
Brent, Drugs , 2001, 61 , 979-988 (Управление отравлением этиленгликолем) - Р. Скалли, Д. Фергюсон, М. Смарт и А. Томас, Am. Fam. Врач , 2002, 66 , 807–812. (лечение отравления этиленгликолем)
- M. Battistella, Ann. Pharmacother ., 2002, 6 , 1085-1089
- Р. Д. Кокс и В. Дж. Филлипс, Военная медицина , 2004, 169 . 660-663.
- М. Ловрич, П. Гранич, М. Чебрило-Турек, З. Лалич и Й. Сертич, Forensic Science International , 2007, 170 , 213–215 (противоядие на основе этанола).
- J. Brent, New Engl. J. Med. , 2009, 360 , 2216-2223.
- К. Дж. Лепик, А. Р. Леви, Б. Г. Соболев, Р. А. Пурселл, К. Р. ДеВитт, Г. Д. Эрхард, Дж. Р. Кеннеди, Д. Э. Доус и Дж. Л. Бриньял, Ann. Emerg. Med. , 2009, 53 , 439–450.e10 (сравнение этанола и фомепизола)
Диэтиленгликоль (ДЭГ) и связанные с ним смертельные случаи
- E.
 М. К. Гейлинг и П. Р. Кэннон, JAMA . 1938, 111 , 919-926 (смерть от сульфаниламидного эликсира в США)
М. К. Гейлинг и П. Р. Кэннон, JAMA . 1938, 111 , 919-926 (смерть от сульфаниламидного эликсира в США) - М. Ханиф, М. Р. Мобарак, А. Ронан, Д. Рахман, Дж. Дж. Донован-младший и М. Бенниш, BMJ , 1995, 311 , 88-91 (смертельные случаи в Бангладеш из-за ДЭГ в качестве растворителя в эликсире парацетамола)
- R. Malebranche, C. Heckdivert, A. Lassegue, и др., Morb. Смертный. Wkly. Rep. 1996, 45 , 649–650. (погибло на Гаити)
- К.Л. О’Брайен, Дж. Д. Селаникио, К. Хекдиверт, М-Ф. Пласид, М. Луис, Д. Б. Барр, Дж. Р. Барр, Дж. Хоспедалес, М. Дж. Льюис, Б. Шварц, Р. М. Филен, С. Сент-Виктор, Дж. Эспиндола, Л. Л. Нидхэм и К. Денервилл, JAMA . 1998, 279 , 1175-1180 (погибло на Гаити)
- Т. Хагер, Демон под микроскопом: от больниц на поле боя до нацистских лабораторий, Героический поиск одного доктора в поисках первого чудодейственного препарата в мире , Нью-Йорк, Гармония, (2006). (сульфаниламидный эликсир)
- Ф.
 Эрнандес, М. Ибаньес и Х. В. Санчо, Anal. Bioanal Chem. , 2008, 391 , 1021–1027 (обнаружение ДЭГ в зубной пасте)
Эрнандес, М. Ибаньес и Х. В. Санчо, Anal. Bioanal Chem. , 2008, 391 , 1021–1027 (обнаружение ДЭГ в зубной пасте) - J. G. Schier, C. S. Rubin, D. Miller, D. Barr и M. A. McGeehin, Public Health Pol. , 2009, 30 , 127-143. (обзор отравлений ДЭГ)
- L. M. Besenhofer, M. C. McLaren, B. Latimer, M. Bartels, M. J. Filary, A. W. Perala и K. E. McMartin, Toxicological Sci. , 2011, 123 , 374–383 (механизм токсичности ДЭГ)
- Н.Willy (ed), 1985 Diethylene Glycol Wine Scandal , Culp Press, 2011.
- L. Conklin, JJ Sejvar, S. Kieszak, R. Sabogal, C. Sanchez, D. Flanders, F. Tulloch, G. Victoria, G. Rodriguez, N. Sosa, MA McGeehin и JG Schier, JAMA Intern . Med. , 2014, 174 , 912-917 (отдаленные почечные и неврологические исходы у выживших после отравления Панамским ДЭГ в 2006 году)
- Н. Р. Соса, Г. М. Родригес, Дж. Г. Шиер и Дж. Дж. Сейвар, Annals of Emergency Medicine , 2014, 64 , 38-47 (особенности отравления ДЭГ в Панаме в 2006 г.
 плюс история массовых отравлений ДЭГ)
плюс история массовых отравлений ДЭГ) - Х.Камада, Х. Сузуки, С. Ямамото, Р. Номура и С. Кусимото, Acute Medicine & Surgery , 2017, 4 , 326–328 (восстановление после отравления DEG за 2-летний период)
Вернуться на страницу «Молекула месяца». [DOI: 10.6084 / m9.figshare.5611279]
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
 Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie. - Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.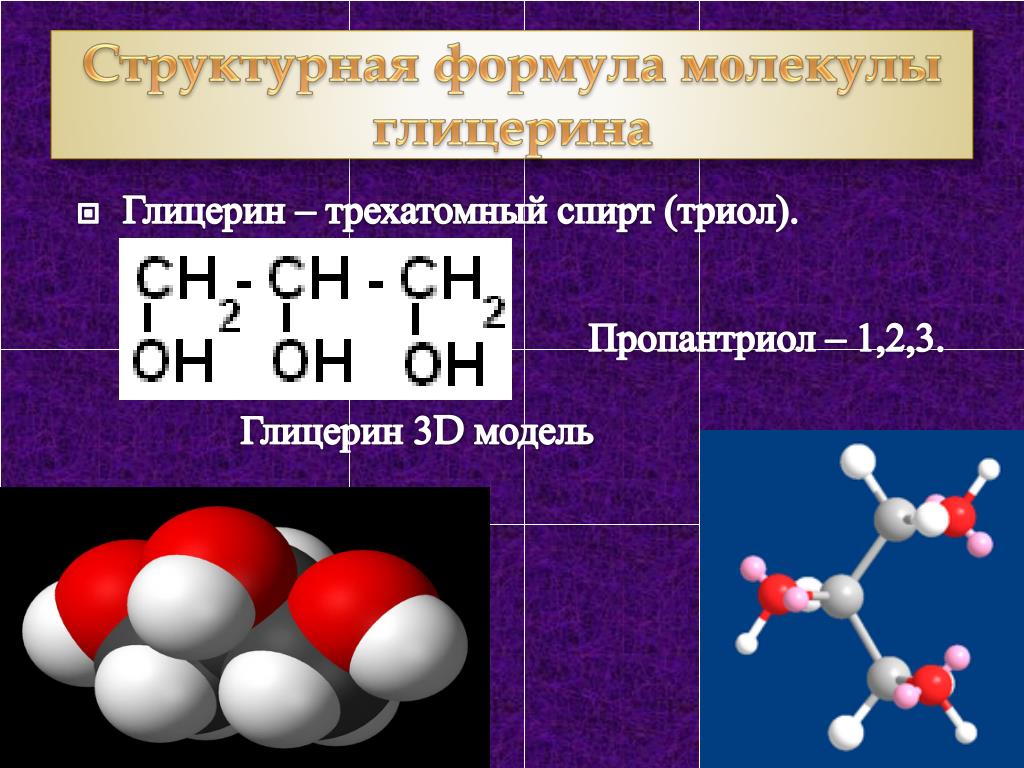 Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Пропиленгликоль — Энциклопедия Нового Света
| Пропиленгликоль [1] | |
|---|---|
| Название ИЮПАК | пропан-1,2-диол |
| Другие наименования | пропиленгликоль, 1,2-пропандиол, 1,2-дигидроксипропан, метилэтилгликоль (МЭГ), метилэтиленгликоль, PG, Sirlene, Dowfrost |
| Идентификаторы | |
| Номер CAS | [57-55-6] |
| Номер RTECS | TY6300000 |
| УЛЫБКИ | CC (O) CO |
| Недвижимость | |
| Химическая формула | C 3 H 8 O 2 |
| Молярная масса | 76. 09 г / моль 09 г / моль |
| Плотность | 1,036 г / см³ |
| Температура плавления | -59 ° С |
| Температура кипения | 188,2 ° С |
| Растворимость в воде | полностью смешивается |
| Растворимость в этаноле | полностью смешивается |
| Растворимость в диэтиловом эфире | полностью смешивается |
| Растворимость в ацетоне | полностью смешивается |
| Растворимость в хлороформе | полностью смешивается |
| Теплопроводность | 0.34 Вт / м-К (50% h3O при 90 ° C) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| NFPA 704 | 1 0 0 |
| S-фразы | S24 S25 |
| Родственные соединения | |
| Родственные гликоли | Этиленгликоль |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | |
Пропиленгликоль , также известный под систематическим названием пропан-1,2-диол, представляет собой органическое соединение с химической формулой C 3 H 8 O 2 .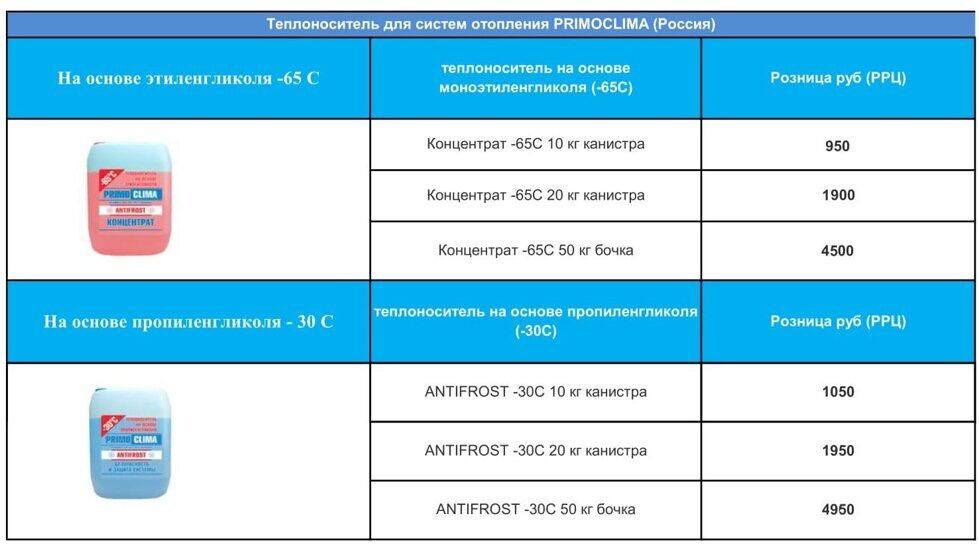 При стандартных условиях (температура 25 ° C и давление 100 кПа) это бесцветная вязкая жидкость без запаха.
При стандартных условиях (температура 25 ° C и давление 100 кПа) это бесцветная вязкая жидкость без запаха.
Это химическое вещество имеет множество применений. Он используется в качестве увлажняющего крема в продуктах питания, лекарствах и различных предметах личной гигиены. Это хороший охлаждающий агент в системах жидкостного охлаждения, растворитель для пищевых красителей и ароматизаторов, а также растворитель для фотографических химикатов. Он является носителем ароматических масел и основным ингредиентом дезодорантов. Он используется для удаления льда с самолетов и создания искусственного дыма.Это также рабочая жидкость в гидравлических прессах.
Пропиленгликоль имеет незначительную токсичность при пероральном приеме с пищей и лекарствами. Кроме того, он не раздражает кожу даже при длительном контакте. Однако высокое потребление этого вещества в течение относительно короткого периода времени может иметь токсические эффекты.
Номенклатура
Как отмечалось выше, систематическое название пропиленгликоля — пропан-1,2-диол, одобренное Международным союзом чистой и прикладной химии (IUPAC). Кроме того, он упоминается как PG, 1,2-пропандиол, 1,2-дигидроксипропан, метилэтилгликоль (MEG) или метилэтиленгликоль.
Кроме того, он упоминается как PG, 1,2-пропандиол, 1,2-дигидроксипропан, метилэтилгликоль (MEG) или метилэтиленгликоль.
Недвижимость
Свойства пропиленгликоля аналогичны свойствам этиленгликоля (моноэтиленгликоль или МЭГ). [2]
Пропиленгликоль смешивается с водой и различными органическими растворителями, такими как этанол, эфир, ацетон и хлороформ. Кроме того, он гигроскопичен, то есть легко впитывает воду из окружающего воздуха.Он имеет температуру кипения 188,2 ° C и точку плавления -59 ° C.
Каждая молекула пропиленгликоля состоит из цепочки из трех атомов углерода (как в пропане) с двумя гидроксильными (или «спиртовыми», ОН) функциональными группами, присоединенными к двум соседним атомам углерода. Поэтому он классифицируется как «диол». Химическая формула может быть записана как CH 2 OH-CHOH-CH 3 .
Изомеры
В каждой молекуле пропиленгликоля центральный углерод присоединен к четырем различным группам атомов, и, следовательно, это асимметричный атом. Следовательно, молекула существует в двух формах, известных как стереоизомеры. Коммерческий продукт представляет собой смесь обеих форм, называемую рацемической смесью. Чистые оптические изомеры можно получить путем гидратации оптически чистого оксида пропилена. [3]
Следовательно, молекула существует в двух формах, известных как стереоизомеры. Коммерческий продукт представляет собой смесь обеих форм, называемую рацемической смесью. Чистые оптические изомеры можно получить путем гидратации оптически чистого оксида пропилена. [3]
Производство
В промышленности пропиленгликоль получают путем гидратации оксида пропилена. Производители могут использовать некаталитический высокотемпературный процесс при 200–220 ° C или каталитический способ, который протекает при 150–180 ° C в присутствии ионообменной смолы или небольших количеств серной кислоты или щелочи.Конечные продукты содержат 20 процентов 1,2-пропандиола, 1,5 процента дипропиленгликоля и небольшие количества других полипропиленгликолей. [3] Пропиленгликоль также можно превратить из глицерина, побочного биодизельного продукта.
Приложения
Пропиленгликоль находит множество применений. Это используется:
- В качестве увлажняющего крема в лекарствах, косметике, продуктах питания, зубной пасте, жидкости для полоскания рта и табачных изделиях
- В дезинфицирующих средствах для рук, антибактериальных лосьонах и солевых растворах
- В качестве основного ингредиента в стиках-дезодорантах
- В качестве эмульгатора в ангостурных и апельсиновых биттерах
- В качестве растворителя пищевых красителей и ароматизаторов
- В качестве растворителя для смешивания фотографических химикатов, например проявителей пленки
- В качестве увлажняющей пищевой добавки, обозначенной номером E E1520
- В качестве охлаждающей жидкости в системах жидкостного охлаждения, например, в бродильных чанах с гликолевой рубашкой для пива и вина
- В крионике
- В качестве менее токсичного антифриза (по сравнению с этиленгликолем)
- В качестве носителя ароматических масел
- В качестве рабочей жидкости в гидравлических прессах
- Как убивающее и консервирующее средство в ловушках-ловушках, обычно используемых для отлова жужелиц
- Для лечения кетоза домашнего скота
- Для удаления льда с самолета.
 [4]
[4] - В дымовых машинах для создания искусственного дыма для использования на тренировках пожарных и в театральных постановках
- В электронных сигаретах, чтобы пар напоминал сигаретный дым
Безопасность
Оральная токсичность пропиленгликоля очень низкая. В одном исследовании крысам давали корм, содержащий до 5 процентов PG в течение 104 недель, и у них не было никаких явных побочных эффектов. [5] Однако были случаи отравления пропиленгликолем в результате ненадлежащего внутривенного введения или случайного проглатывания детьми. [6]
Серьезная токсичность возникает только при очень высоких дозах в течение относительно короткого периода времени, когда его концентрация в плазме крови поднимается выше 4 г / л. [7] Такие уровни проглатывания были бы невозможны при потреблении разумных количеств пищевого продукта или диетической добавки, содержащих максимум 1 г / кг пропиленгликоля.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) классифицировало пропиленгликоль как «общепризнанный безопасный» для использования в пищевых продуктах, косметике и лекарствах.Как и этиленгликоль, пропиленгликоль влияет на химию организма, увеличивая количество кислоты. Пропиленгликоль метаболизируется в пировиноградную кислоту, которая является нормальным метаболитом при расщеплении глюкозы, а этиленгликоль метаболизируется в щавелевую кислоту, которая токсична.
Однако пропиленгликоль не одобрен для использования в кормах для кошек. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США определило, что пропиленгликоль в корме для кошек или в корме для кошек не был признан адекватными научными данными как безопасный для использования.Использование пропиленгликоля в корме или на корме для кошек приводит к фальсификации корма и нарушению Федерального закона о пищевых продуктах, лекарствах и косметических средствах. 21CFR589.1001
21CFR589.1001
Продолжительный контакт с пропиленгликолем практически не раздражает кожу. Неразбавленный пропиленгликоль минимально раздражает глаза и может вызвать легкий преходящий конъюнктивит (глаз восстанавливается после удаления воздействия). Воздействие тумана может вызвать раздражение глаз, а также раздражение верхних дыхательных путей.Вдыхание паров пропиленгликоля не представляет особой опасности для обычных применений. Однако ограниченный человеческий опыт показывает, что вдыхание тумана пропиленгликоля может вызывать у некоторых людей раздражение. Поэтому следует избегать вдыхания тумана этих материалов. Некоторые исследования показали, что пропиленгликоль не должен использоваться там, где вероятно вдыхание или контакт глаз человека с аэрозольными аэрозолями этих материалов, таких как туманы для театральных постановок или растворы антифризов для станций аварийного промывания глаз.
Пропиленгликоль не вызывает сенсибилизации и не показывает никаких доказательств того, что он канцероген или генотоксичен. [8] [9]
[8] [9]
В недавней статье Clinical Journal of Medicine говорится о двух случаях, когда взрослые мужчины испытывали психоз из-за использования пропиленгликоля, используемого для инъекций фенитоина USP. Оба пациента были переведены на церебикс (натрий фосфенитоин), чтобы избежать сорастворителя пропиленгликоля.
Аллергическая реакция
Исследования показали, что люди, которые не переносят пропиленгликоль, вероятно, испытывают особую форму раздражения, но лишь в редких случаях у них развивается аллергический контактный дерматит.Другие исследователи полагают, что частота аллергического контактного дерматита на пропиленгликоль может составлять более 2 процентов у пациентов с экземой. [10]
Пациенты с вульводинией и интерстициальным циститом могут быть особенно чувствительны к пропиленгликолю. Женщины, борющиеся с дрожжевыми инфекциями, также могут заметить, что некоторые безрецептурные кремы могут вызывать сильное жжение. [11] Женщины в постменопаузе, которым требуется крем с эстрогеном, могут заметить, что фирменные кремы, изготовленные с пропиленгликолем, часто вызывают сильное, неприятное жжение вдоль вульвы и перианальной области.В этих случаях пациенты могут попросить местную аптеку приготовить крем «без пропиленгликоля».
[11] Женщины в постменопаузе, которым требуется крем с эстрогеном, могут заметить, что фирменные кремы, изготовленные с пропиленгликолем, часто вызывают сильное, неприятное жжение вдоль вульвы и перианальной области.В этих случаях пациенты могут попросить местную аптеку приготовить крем «без пропиленгликоля».
См. Также
Банкноты
- ↑ Merck Index , 11-е издание, 7868 .
- ↑ Обратите внимание, что пропиленгликоль иногда также называют аббревиатурой MEG, но как сокращение от метилэтилгликоля.
- ↑ 3,0 3,1 1,2-пропандиол. CHEMINDUSTRY.RU. Проверено 12 января 2009 года.
- ↑ Что это за штука ?: Aircraft Deicers.Новости C&EN. Проверено 12 января 2009 года.
- ↑ I.F. Gaunt и др., Апрель 1972 г. «Долгосрочная токсичность пропиленгликоля у крыс», Food and Cosmetics Toxicology . 10 (2): 151-162.
- ↑ Национальная медицинская библиотека. 2005. Выдержки по токсичности для человека: Регистрационный номер CAS: 57-55-6 (1,2-пропиленгликоль).
 Избранная информация о токсичности из HSDB.
Избранная информация о токсичности из HSDB. - ↑ Flanagan, R.J., et al. 1995. Международная программа химической безопасности: фундаментальная аналитическая токсикология. ВОЗ.
- ↑ 1,2-Дигидроксипропан. Отчет о первоначальной оценке малых островных развивающихся государств для 11-го SIAM, США, 23–26 января 2001 г., стр. 21. Публикации ЮНЕП. Проверено 12 января 2009 года.
- ↑ Раздел 21, Свод федеральных правил США. 1999 г.
- ↑ Американская медицинская ассоциация, Совет по лекарствам. Ежегодная оценка лекарственных средств AMA, 1994 г. . Чикаго, Иллинойс: Американская медицинская ассоциация, 1994, 1224.
- ↑ Элизабет Влит, 1995, Кричать, чтобы быть услышанным: гормональные связи, которые женщины подозревают, а врачи игнорируют. Нью-Йорк: М. Эванс и компания.
Список литературы
- Макмерри, Джон. 2004. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс / Коул. ISBN 0534420052.

- Моррисон, Роберт Т. и Роберт Н. Бойд. 1992. Органическая химия, 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. ISBN 0136436692.
- Solomons, T.W. Грэхем и Крейг Б. Фрайл. 2004. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: Джон Вили. ISBN 0471417998.
- Yaws, Carl L. 2005. Справочник Yaws по физическим свойствам углеводородов и химикатов: физические свойства более 41 000 органических и неорганических химических соединений: охват для органических соединений C1 — C100 и неорганических соединений Ac — Zr. Хьюстон: Паб Персидского залива. Co. ISBN 9780976511373.
Внешние ссылки
Все ссылки получены 15 июня 2019 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в энциклопедию Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Водорастворимые комплексы, образующиеся при взаимодействии водородных связей между триблок-сополимером, содержащим полиэтиленгликоль, и поли (метакриловой кислотой)
Мы провели радикальную полимеризацию SS с использованием ОПЦ-ПЭГ-КПД ( M n = 1,00 × 10 4 , M w / M n = 1,18). Полимеризация SS с использованием CPD-PEG-CPD протекала контролируемым образом, как показано на рисунке 2. На рисунке 2a изображена зависимость время-конверсия вместе с кинетическим графиком первого порядка для полимеризации SS в присутствии CPD. -ПЭГ-ЦПД при 70 ° C в D 2 O в атмосфере Ar.Расход мономера контролировали с помощью спектроскопии ЯМР 1 H в зависимости от времени полимеризации. Период индукции составлял ~ 84 мин, что могло быть связано с медленной скоростью образования радикального фрагмента 4-цианопентановой кислоты, как сообщили McCormick с соавторами. 27 Конверсия мономера 98,2% была достигнута в течение 6 часов. График кинетики ОПЦ-полимеризации SS, показанный на рисунке 2а, показывает, что концентрация радикала роста оставалась постоянной во время полимеризации.
На рисунке 2a изображена зависимость время-конверсия вместе с кинетическим графиком первого порядка для полимеризации SS в присутствии CPD. -ПЭГ-ЦПД при 70 ° C в D 2 O в атмосфере Ar.Расход мономера контролировали с помощью спектроскопии ЯМР 1 H в зависимости от времени полимеризации. Период индукции составлял ~ 84 мин, что могло быть связано с медленной скоростью образования радикального фрагмента 4-цианопентановой кислоты, как сообщили McCormick с соавторами. 27 Конверсия мономера 98,2% была достигнута в течение 6 часов. График кинетики ОПЦ-полимеризации SS, показанный на рисунке 2а, показывает, что концентрация радикала роста оставалась постоянной во время полимеризации.
( a ) Графики преобразования времени (○) и кинетики первого порядка (□) для полимеризации SS в присутствии CPD-PEG-CPD в воде при 70 ° C. [M] , 0, и [M] представляют концентрации мономера при времени полимеризации 0 и соответствующем времени соответственно. (b ) Кривые элюирования GPC, демонстрирующие изменение молекулярной массы во время полимеризации SS с использованием CPD-PEG-CPD. Преобразования показаны для каждого пика.( c ) Зависимость M n (○) и M w / M n (Δ) от конверсии мономера при полимеризации SS в присутствии CPD-PEG-CPD .
(b ) Кривые элюирования GPC, демонстрирующие изменение молекулярной массы во время полимеризации SS с использованием CPD-PEG-CPD. Преобразования показаны для каждого пика.( c ) Зависимость M n (○) и M w / M n (Δ) от конверсии мономера при полимеризации SS в присутствии CPD-PEG-CPD .
На фиг. 2b показаны кривые элюирования GPC для полимеризации SS в присутствии CPD-PEG-CPD. Значительное увеличение молекулярной массы произошло при полимеризации SS, что указывает на образование блок-сополимера PSS – PEG – PSS. Ни нового пика, ни плеча из-за присутствия гомополимеров ПСС не наблюдалось.Таким образом, был сделан вывод об отсутствии одновременной гомополимеризации SS.
На рисунке 2c значения M n и M w / M n для триблок-сополимера PSS – PEG – PSS, оцененные на основе измерений GPC, представлены как функция степень конверсии СС. Значение M n увеличилось с преобразованием, тогда как значение M w / M n осталось в довольно узком диапазоне 1. 07–1.27, независимо от преобразования. Полимеризация ПМА в присутствии CPD также протекала контролируемым образом с узким значением M w / M n (1,14). 17
07–1.27, независимо от преобразования. Полимеризация ПМА в присутствии CPD также протекала контролируемым образом с узким значением M w / M n (1,14). 17
На рис. 3 представлены спектры ЯМР 1 H PSS-PEG-PSS, PMA и комплекса PSS-PEG-PSS / PMA в D 2 O, содержащем 0,1 M NaCl, при pH 3. В спектре ПСС – ПЭГ – ПСС, резонансная полоса наблюдается при 0.9–2.3 м.д. был отнесен к протонам основной цепи блоков PSS.DP блоков PSS в PSS – PEG – PSS и M n (ЯМР) для PSS – PEG – PSS определяли по соотношению интенсивностей резонансных полос, связанных с боковыми фенильными протонами в блоке PSS при 6,1–7,9 частей на миллион и протоны основной цепи ПЭГ при 3,7 м.д. Как показано на рисунке 3b, резонансные полосы наблюдаются в диапазоне 0,6–2,8 ppm. области в спектре PMA были отнесены к α -метильным протонам и метиленовым протонам основной цепи, соответственно. DP и M n (ЯМР) PMA определяли на основании отношения интенсивностей резонансных полос, обусловленных концевыми фенильными протонами при 7. 17–8.4 вечера и протоны основной цепи PMA при 0,6–2,8 м.д.
17–8.4 вечера и протоны основной цепи PMA при 0,6–2,8 м.д.
1 Спектры ЯМР H, измеренные в D 2 O, содержащем 0,1 М NaCl, при pH 3 для ( a ) PSS – PEG – PSS, ( b ) PMA и ( c ) комплекс ПСС – ПЭГ – ПСС / ПМА. Отнесения указаны для резонансных пиков. Полная цветная версия этого рисунка доступна в Интернете по адресу Polymer Journal .
Если предполагается, что полимеризация протекает идеально в природе, то теоретическая среднечисленная молекулярная масса ( M n (theo)) может быть рассчитана как
, где [M] 0 — начальная концентрация мономера. , [CTA] 0 — начальная концентрация CPD-PEG-CPD, x m — процентное превращение мономера, M m — молекулярная масса мономера и M CTA — это молекулярная масса CPD-PEG-CPD.Значения M n (ЯМР) для PSS-PEG-PSS и PMA были рассчитаны на основе данных 1 H ЯМР. Как показано в таблице 1, значение M n (ЯМР) для PSS – PEG – PSS разумно согласуется с M n (theo). Однако значения M n (theo) и M n (GPC) для PSS – PEG – PSS немного различались, поскольку PSS использовался в качестве стандартного полимера для калибровки M n (GPC ), а его отношение объема к массе может отличаться от соотношения PSS – PEG – PSS. 28, 29 Значение M n (ЯМР) для PMA было относительно близко к значению M n (theo).
Как показано в таблице 1, значение M n (ЯМР) для PSS – PEG – PSS разумно согласуется с M n (theo). Однако значения M n (theo) и M n (GPC) для PSS – PEG – PSS немного различались, поскольку PSS использовался в качестве стандартного полимера для калибровки M n (GPC ), а его отношение объема к массе может отличаться от соотношения PSS – PEG – PSS. 28, 29 Значение M n (ЯМР) для PMA было относительно близко к значению M n (theo).
На рисунке 3c показан ЯМР 1 H спектр смеси ПСС – ПЭГ – ПСС и ПМА, приготовленной в D 2 O, содержащей 0.1 М NaCl, при pH 3.Предполагалось, что комплекс PSS-PEG-PSS / PMA будет формировать структуру мицелл ядро-оболочка, в которой комплексные блоки PEG / PMA формируют ядро, а блоки PSS окружают ядро, чтобы сформировать слой оболочки. Чтобы получить дополнительную информацию об ограничении движения блоков ПЭГ, были измерены времена спин-спиновой релаксации 1 H ЯМР ( T 2 ) для PSS-PEG-PSS и комплекса PSS-PEG-PSS / PMA; уменьшение T 2 предполагает ограниченное движение протонов. 30, 31 Значение T 2 при 3,7 p.pm для протонов ПЭГ в ПСС-ПЭГ-ПСС до смешивания с ПМА составляло 160 мс, тогда как Т 2 для протонов ПЭГ в комплексе было короче ( Т 2 = 41,5 мс). Это наблюдение указывает на ограниченное движение блоков PEG в комплексе из-за водородной связи между блоком PEG и PMA.
Чтобы получить дополнительную информацию об ограничении движения блоков ПЭГ, были измерены времена спин-спиновой релаксации 1 H ЯМР ( T 2 ) для PSS-PEG-PSS и комплекса PSS-PEG-PSS / PMA; уменьшение T 2 предполагает ограниченное движение протонов. 30, 31 Значение T 2 при 3,7 p.pm для протонов ПЭГ в ПСС-ПЭГ-ПСС до смешивания с ПМА составляло 160 мс, тогда как Т 2 для протонов ПЭГ в комплексе было короче ( Т 2 = 41,5 мс). Это наблюдение указывает на ограниченное движение блоков PEG в комплексе из-за водородной связи между блоком PEG и PMA.
На рис. 4 показаны гидродинамические радиусы ( R h ) и интенсивности светорассеяния для смеси PSS – PEG – PSS и PMA в 0.1 M NaCl при pH 3 в зависимости от f EG . Общее C p сохранялось постоянным на уровне 0,83 г л -1 . Увеличение интенсивности рассеяния свидетельствует об увеличении размеров комплекса. Максимум R h и интенсивность рассеяния наблюдались при f EG = 0,5. Эти результаты показывают, что стехиометрическое взаимодействие в смеси ПСС – ПЭГ – ПСС и ПМА привело к образованию комплекса с максимальным числом агрегации.В данном исследовании использовали комплекс с f EG = 0,5, если не указано иное.
Максимум R h и интенсивность рассеяния наблюдались при f EG = 0,5. Эти результаты показывают, что стехиометрическое взаимодействие в смеси ПСС – ПЭГ – ПСС и ПМА привело к образованию комплекса с максимальным числом агрегации.В данном исследовании использовали комплекс с f EG = 0,5, если не указано иное.
Гидродинамические радиусы ( R h ) (○) и интенсивности светорассеяния (Δ) комплексов PSS – PEG – PSS / PMA в зависимости от f EG ([EG] / ([MA] + [EG])) в 0,1 М водных растворах NaCl при pH 3. Общая концентрация полимера была зафиксирована на уровне 0,83 г / л -1 . [EG] и [MA] представляют концентрации этиленгликоля и единиц MA соответственно.
На рисунке 5 показаны распределения R h для полимеров при pH 3 и комплекса PSS-PEG-PSS / PMA при pH 3 и 10. Значения R h были определены с помощью DLS в 0,1 M NaCl; они показаны в Таблице 2. Значения R h для PSS-PEG-PSS и PMA составляли 4,9 и 4,7 нм, соответственно, что приемлемо для унимерного состояния. Значения комплекса R h при pH 3 и 10 составили 43,4 и 4,8 нм соответственно.Был сделан вывод, что когда PSS-PEG-PSS и PMA смешиваются в 0,1 M NaCl при pH 3, водорастворимый комплекс образуется за счет взаимодействия водородных связей между блоком PEG и PMA, и этот комплекс диссоциирует при pH 10, поскольку водород Связывающее взаимодействие исчезает в результате депротонирования боковых карбоновых кислот в PMA.
Значения R h для PSS-PEG-PSS и PMA составляли 4,9 и 4,7 нм, соответственно, что приемлемо для унимерного состояния. Значения комплекса R h при pH 3 и 10 составили 43,4 и 4,8 нм соответственно.Был сделан вывод, что когда PSS-PEG-PSS и PMA смешиваются в 0,1 M NaCl при pH 3, водорастворимый комплекс образуется за счет взаимодействия водородных связей между блоком PEG и PMA, и этот комплекс диссоциирует при pH 10, поскольку водород Связывающее взаимодействие исчезает в результате депротонирования боковых карбоновых кислот в PMA.
R h Распределения для ( a ) PSS – PEG – PSS и ( b ) PMA в 0,1 M NaCl при pH 3 и комплекса PSS – PEG – PSS / PMA при ( c ) pH 3 и ( d ) pH 10.
Таблица 2 Данные по светорассеянию для PSS – PEG – PSS, PMA и комплекса PSS – PEG – PSS / PMA при pH 3 Были нанесены на график скорости релаксации ( Γ ), измеренные при различных углах рассеяния ( θ ). как функция квадрата модуля вектора рассеяния ( q 2 ) на рисунке 6a. Линейная зависимость, проходящая через начало координат, указывает на то, что релаксационные моды практически диффузные. 32 R h значение 42.9 нм, оцененная по наклону графика Γ по сравнению с q 2 , оказалась в хорошем согласии со значением R h (43,4 нм), рассчитанным по пику R . h Распределение , полученное при θ = 90 ° (рисунок 5c). Поскольку угловая зависимость была незначительной, значения R h были оценены при фиксированном θ , равном 90 °. На рисунке 6b R h нанесен на график против C p .Значения R h для комплекса были практически постоянными ( R h = приблизительно 42 нм) в диапазоне C p от 0,17 до 0,83 г л -1 .
как функция квадрата модуля вектора рассеяния ( q 2 ) на рисунке 6a. Линейная зависимость, проходящая через начало координат, указывает на то, что релаксационные моды практически диффузные. 32 R h значение 42.9 нм, оцененная по наклону графика Γ по сравнению с q 2 , оказалась в хорошем согласии со значением R h (43,4 нм), рассчитанным по пику R . h Распределение , полученное при θ = 90 ° (рисунок 5c). Поскольку угловая зависимость была незначительной, значения R h были оценены при фиксированном θ , равном 90 °. На рисунке 6b R h нанесен на график против C p .Значения R h для комплекса были практически постоянными ( R h = приблизительно 42 нм) в диапазоне C p от 0,17 до 0,83 г л -1 .
( a ) Зависимость между скоростью релаксации (Γ) и квадратом величины вектора рассеяния ( q 2 ) для комплекса PSS – PEG – PSS / PMA при ° C. p = 0,83 г л −1 дюйм 0.1 M NaCl при pH 3. ( b ) R h для комплекса как функция C p в 0,1 M NaCl при pH 3.
p = 0,83 г л −1 дюйм 0.1 M NaCl при pH 3. ( b ) R h для комплекса как функция C p в 0,1 M NaCl при pH 3.
На рисунке 7a показаны интенсивности светорассеяния 0,1 Водные растворы M NaCl комплекса PSS – PEG – PSS / PMA нанесены на график против C p . Интенсивность резко возрастала с увеличением C p выше порога 0,057 г л -1 . Это наблюдение предполагает, что образование комплекса между PSS-PEG-PSS и PMA начало происходить выше C p , равного 0.057 г л −1 . Кажущееся значение критической концентрации агрегатов (САС) для комплекса, оцененное по графику, составило 0,057 г / л -1 .
Рисунок 7 ( a ) Интенсивность светорассеяния комплекса PSS-PEG-PSS / PMA в зависимости от C p в 0,1 M NaCl при pH 3. ( b ) Интенсивность флуоресценции в ANS (0,02 мМ) в присутствии комплекса PSS-PEG-PSS / PMA в зависимости от C p в 0,1 M NaCl при pH 3.
ANS обычно используется в качестве флуоресцентного зонда для исследования молекулярных ансамблей поверхностно-активных веществ и амфифильных полимеров, поскольку интенсивность флуоресценции ANS увеличивается в гидрофобной среде. 33 На рисунке 7b интенсивность флуоресценции ANS в присутствии комплекса PSS-PEG-PSS / PMA представлена как функция от C p . Интенсивность постепенно увеличивалась в нижней области C p , но начала увеличиваться более круто при значениях C p выше 0.058 г л -1 . Это увеличение указывает на существование гидрофобных микродоменов, образованных взаимодействиями водородных связей между блоком PEG и PMA. Кажущееся значение CAC для комплекса было оценено графически как 0,058 г / л -1 ; кажущееся значение CAC, основанное на измерениях флуоресценции ANS, было довольно близко к оцененному по данным светорассеяния.
Кажущиеся значения M w и R g , определенные измерениями статического светорассеяния, перечислены в таблице 2. На рис. 8 показаны графики Зимма для комплекса PSS – PEG – PSS / PMA. Число агрегации ( N agg ) для комплекса, определяемое как общее количество полимерных цепей, образующих один комплекс, можно рассчитать из отношения значений M w для комплекса и мнимера. Результат этого расчета дает N agg 270 для комплекса. Цепные числа PSS-PEG-PSS и PMA для одного комплекса составляли 119 и 151 соответственно, как рассчитано из f EG = 0.5 и значения DP PEG и PMA.
На рис. 8 показаны графики Зимма для комплекса PSS – PEG – PSS / PMA. Число агрегации ( N agg ) для комплекса, определяемое как общее количество полимерных цепей, образующих один комплекс, можно рассчитать из отношения значений M w для комплекса и мнимера. Результат этого расчета дает N agg 270 для комплекса. Цепные числа PSS-PEG-PSS и PMA для одного комплекса составляли 119 и 151 соответственно, как рассчитано из f EG = 0.5 и значения DP PEG и PMA.
Графики Зимма для комплекса PSS – PEG – PSS / PMA в 0,1 М водном растворе NaCl при pH 3. Углы составляют от 30 ° до 130 ° с шагом 20 °.
Значение R g / R h полезно для характеристики формы молекулярных ансамблей. Теоретическое значение R г / R h для однородной твердой сферы составляет 0,778, но это значение существенно увеличивается для менее плотных структур и полидисперсных смесей; например, R г / R h = 1. 5–1,7 для гибких линейных цепей в хороших растворителях, тогда как R г / R h ⩾2 для жесткого стержня. 34, 35, 36 Как показано в таблице 2, соотношение R g / R h для комплекса оказалось равным 0,72, что позволяет предположить, что форма комплекса была близка к сферической. Отношения R g / R h для PSS – PEG – PSS и PMA составляли 2,55 и 1,90, соответственно, что указывает на то, что эти полимеры имели относительно расширенные конформации.
5–1,7 для гибких линейных цепей в хороших растворителях, тогда как R г / R h ⩾2 для жесткого стержня. 34, 35, 36 Как показано в таблице 2, соотношение R g / R h для комплекса оказалось равным 0,72, что позволяет предположить, что форма комплекса была близка к сферической. Отношения R g / R h для PSS – PEG – PSS и PMA составляли 2,55 и 1,90, соответственно, что указывает на то, что эти полимеры имели относительно расширенные конформации.
Радиус сердцевины ( R сердцевина ) комплекса PSS – PEG – PSS / PMA, основанный на простой структуре ядро-оболочка, может быть рассчитан из объема каждого полимера следующим образом:
где V core — объем ядра комплекса, M w, PEG и M w, PMA — средневесовые молекулярные массы блоков PEG и PMA, соответственно, и ρ PEG и ρ PMA — плотности блока PEG и PMA, соответственно. Начиная с R g и R сердечник , толщину оболочки ( L ) можно рассчитать как L = R g — R сердечник . Для расчета ядра R использовались объемные плотности мономеров EG и MA ( ρ PEG = 1,11 и ρ PMA = 1,02 г · см −3 ). Таким образом, значения R core и L для комплекса были рассчитаны равными 20.8 и 9,6 нм соответственно. Длина контура блоков PSS с DP 39 может быть рассчитана как 9,8 нм. 37, 38 Значение L = 9,6 нм для комплекса немного меньше контурной длины блоков PSS. Эти результаты показывают, что комплекс состоит из ядра PEG / PMA, образованного взаимодействиями водородных связей, с расширенными оболочками PSS.
Начиная с R g и R сердечник , толщину оболочки ( L ) можно рассчитать как L = R g — R сердечник . Для расчета ядра R использовались объемные плотности мономеров EG и MA ( ρ PEG = 1,11 и ρ PMA = 1,02 г · см −3 ). Таким образом, значения R core и L для комплекса были рассчитаны равными 20.8 и 9,6 нм соответственно. Длина контура блоков PSS с DP 39 может быть рассчитана как 9,8 нм. 37, 38 Значение L = 9,6 нм для комплекса немного меньше контурной длины блоков PSS. Эти результаты показывают, что комплекс состоит из ядра PEG / PMA, образованного взаимодействиями водородных связей, с расширенными оболочками PSS.
На рис. 9 показаны ПЭМ-изображения комплекса PSS – PEG – PSS / PMA. Они представляют собой сферический комплекс со средним диаметром 95 нм.Радиус комплекса, наблюдаемый с помощью ПЭМ, был довольно близок к значению R h , оцененному с помощью DLS.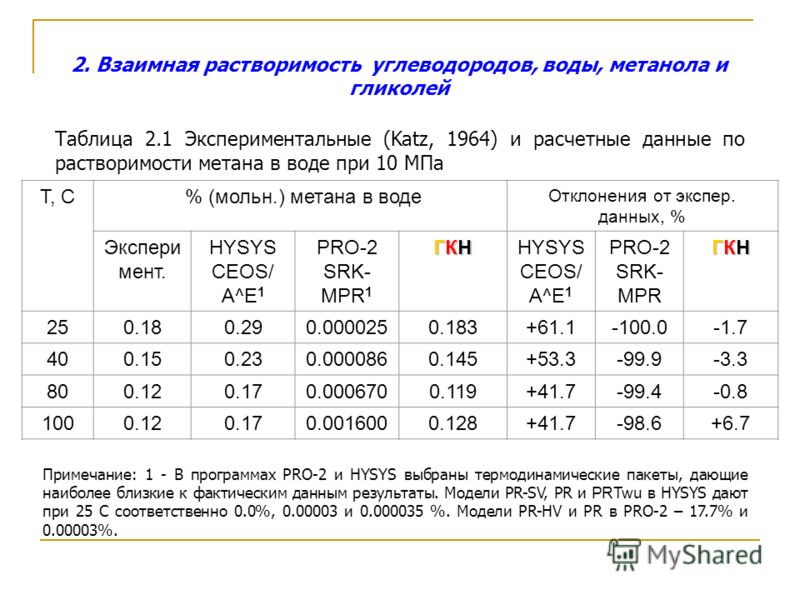
ПЭМ-изображения комплекса PSS – PEG – PSS / PMA. Масштабные линейки составляют ( a ) 100 нм и ( b ) 500 нм.
На рис. 10а показаны значения R h для комплекса PSS – PEG – PSS / PMA в зависимости от pH. При pH выше 4,6 значения R h были порядка 5 нм, что свидетельствует о том, что PSS-PEG-PSS и PMA находились в унимерном состоянии.При понижении pH значение R h начало увеличиваться около pH 4,5, достигая максимального значения 65,9 нм при pH 4,0. По мере того как pH продолжал снижаться, значение R h также начало уменьшаться, изменяясь с 65,9 до 47,9 нм, когда pH раствора снижался с 4,0 до 3,0. Этот результат указывает на то, что комплекс стал более компактным за счет дальнейшего протонирования боковых карбоксилатных групп в PMA. На рисунке 10b показаны интенсивности рассеяния для комплекса в зависимости от pH.Интенсивность рассеяния быстро увеличивалась при снижении pH раствора с 4,9 до 4,0, что позволяет предположить, что комплекс образовался при pH ниже 4,0. Поскольку интенсивность рассеяния пропорциональна молекулярной массе, наблюдение, что интенсивность рассеяния была почти постоянной между pH 4,0 и 3,0, предполагает, что число агрегации комплекса было практически постоянным в этом диапазоне.
Поскольку интенсивность рассеяния пропорциональна молекулярной массе, наблюдение, что интенсивность рассеяния была почти постоянной между pH 4,0 и 3,0, предполагает, что число агрегации комплекса было практически постоянным в этом диапазоне.
( a ) R h значения и ( b ) интенсивности рассеяния для комплекса PSS – PEG – PSS / PMA в зависимости от pH в 0.1 М NaCl.
Полиэтиленгликоль: Полиэтиленгликоль обычно обозначают числом, которое приблизительно соответствует его средней молекулярной массе. По мере увеличения средней молекулярной массы растворимость в воде, давление пара, гигроскопичность и растворимость в органических растворителях уменьшаются, в то время как температура застывания, удельный вес, температура вспышки и вязкость увеличиваются. Жидкости бывают от прозрачных до слегка мутных, бесцветных или практически бесцветных, слегка гигроскопичных, вязких жидкостей, имеющих легкий характерный запах и удельный вес 25, равный примерно 1. 12. Твердые сорта встречаются в виде практически без запаха и вкуса, белого, воскообразного, пластичного материала, имеющего консистенцию, подобную пчелиному воску, или в виде кремово-белых хлопьев, шариков или порошков. В прилагаемой таблице указаны приблизительные температуры застывания, характерные для широко доступных марок. Жидкие марки смешиваются с водой; твердые сорта легко растворяются в воде; и все они растворимы в ацетоне, спирте, хлороформе, моноэтиловом эфире этиленгликоля, этилацетате и толуоле; все нерастворимы в эфире и в гексане.Категория NF: Покрытие; пластификатор; растворитель; суппозиторийная основа; лубрикант для таблеток и / или капсул.
12. Твердые сорта встречаются в виде практически без запаха и вкуса, белого, воскообразного, пластичного материала, имеющего консистенцию, подобную пчелиному воску, или в виде кремово-белых хлопьев, шариков или порошков. В прилагаемой таблице указаны приблизительные температуры застывания, характерные для широко доступных марок. Жидкие марки смешиваются с водой; твердые сорта легко растворяются в воде; и все они растворимы в ацетоне, спирте, хлороформе, моноэтиловом эфире этиленгликоля, этилацетате и толуоле; все нерастворимы в эфире и в гексане.Категория NF: Покрытие; пластификатор; растворитель; суппозиторийная основа; лубрикант для таблеток и / или капсул.| Номинальный молекулярный вес Полиэтиленгликоль | Приблизительная температура застывания () |
|---|---|
| 300 | 11 |
| 400 | 6 |
| 600 | 20 |
| 900 | 34 |
| 1000 | 38 |
| 1450 | 44 |
| 3350 | 56 |
| 4500 | 58 |
| 8000 | 60 |
 По мере увеличения средней молекулярной массы растворимость в воде, давление пара, гигроскопичность и растворимость в органических растворителях уменьшаются, в то время как температура застывания, удельный вес, температура вспышки и вязкость увеличиваются. Жидкости бывают от прозрачных до слегка мутных, бесцветных или практически бесцветных, слегка гигроскопичных, вязких жидкостей, имеющих легкий характерный запах и удельный вес при 25 около 1,09 — 1,10. Твердые сорта встречаются в виде практически без запаха и вкуса, белого, воскообразного, пластичного материала, имеющего консистенцию, подобную пчелиному воску, или в виде кремово-белых хлопьев, шариков или порошков.В прилагаемой таблице указаны приблизительные температуры застывания, характерные для широко доступных марок. Жидкие марки смешиваются с водой; твердые сорта легко растворяются в воде; и все они растворимы в ацетоне, спирте, хлороформе, моноэтиловом эфире этиленгликоля, этилацетате и толуоле; все нерастворимы в эфире и в гексане.
По мере увеличения средней молекулярной массы растворимость в воде, давление пара, гигроскопичность и растворимость в органических растворителях уменьшаются, в то время как температура застывания, удельный вес, температура вспышки и вязкость увеличиваются. Жидкости бывают от прозрачных до слегка мутных, бесцветных или практически бесцветных, слегка гигроскопичных, вязких жидкостей, имеющих легкий характерный запах и удельный вес при 25 около 1,09 — 1,10. Твердые сорта встречаются в виде практически без запаха и вкуса, белого, воскообразного, пластичного материала, имеющего консистенцию, подобную пчелиному воску, или в виде кремово-белых хлопьев, шариков или порошков.В прилагаемой таблице указаны приблизительные температуры застывания, характерные для широко доступных марок. Жидкие марки смешиваются с водой; твердые сорта легко растворяются в воде; и все они растворимы в ацетоне, спирте, хлороформе, моноэтиловом эфире этиленгликоля, этилацетате и толуоле; все нерастворимы в эфире и в гексане.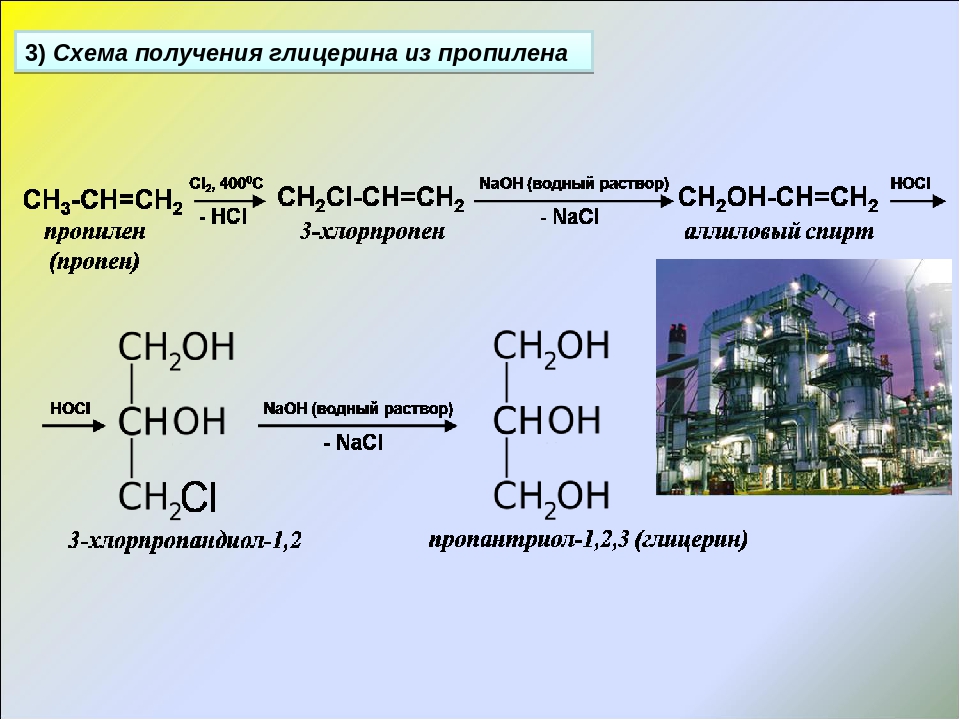 Категория НФ: Мазевая основа; растворитель; пластификатор.
Категория НФ: Мазевая основа; растворитель; пластификатор.| Номинальный молекулярный вес Монометиловый эфир полиэтиленгликоля | Приблизительная температура застывания () |
|---|---|
| 350 | 7 |
| 550 | 17 |
| 750 | 28 |
| 1000 | 35 |
| 2000 | 51 |
| 5000 | 59 |
| 8000 | 60 |
| 10000 | 61 |
(–O – Ch3Ch3–) н.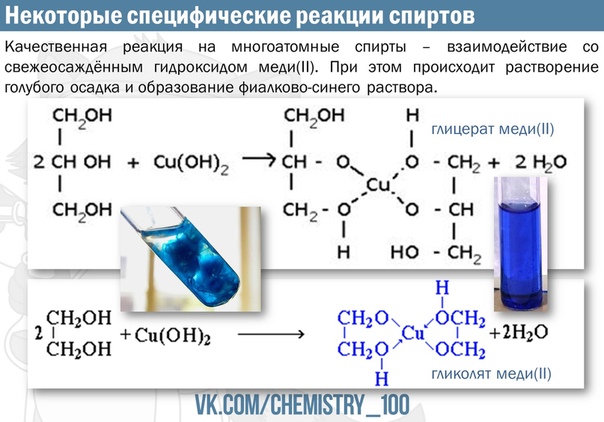
| Приблизительный молекулярный вес | Вязкость типичного раствора (сПз), 25 | |
|---|---|---|
| 5% раствор | 1% раствор | |
| 100 000 | 40 | |
| 200 000 | 100 | |
| 300 000 | 800 | |
| 400 000 | 3000 | |
| 600 000 | 6000 | |
| 900 000 | 15 000 | |
| 4,000,000 | 3500 | |
| 5 000 000 | 5500 | |
Полиэтилен 50 стеарат: Категория NF: Эмульгирующий и / или солюбилизирующий агент.
Полиглицерил-3-диизостеарат: Вязкая жидкость. Растворим в спирте, хлористом метилене, минеральном масле и растительных маслах; не растворим в воде. Категория NF: Эмульгирующий и / или солюбилизирующий агент; мазевая основа.
Добавьте следующее:
Полиглицерилдиолеат: Вязкая жидкость. Растворим в метиленхлориде, минеральном масле и растительных маслах; трудно растворим в спирте; не растворим в воде.Категория NF: Эмульгирующий и / или солюбилизирующий агент.Полиизобутилен: Низкомолекулярные сорта мягкие и липкие; высокомолекулярные марки прочные и эластичные. Все сорта имеют светлый цвет, без запаха и вкуса. Растворим в диизобутилене, толуоле и хлороформе; не растворим в воде.
Сульфат полимиксина B: Порошок от белого до бледно-желтого цвета. Без запаха или имеет слабый запах. Легко растворим в воде; мало растворим в спирте.
Полиоксиллауриловый эфир: Материал с 3–5 звеньями оксиэтилена на молекулу представляет собой бесцветную жидкость. Растворим или диспергируется в спирте; практически не растворим в воде и гексане. Материал с 9–23 оксиэтиленовыми звеньями на молекулу представляет собой белую воскообразную массу. Растворим или диспергируется в воде; растворим в спирте; практически не растворим в гексане. Категория NF: Эмульгирующий и / или солюбилизирующий агент.
Полиоксилолеат: Слегка желтоватая вязкая жидкость.Диспергируется в воде и маслах. Растворим в спирте и изопропиловом спирте. Смешивается с жирными маслами и восками. Его показатель преломления составляет около 1,466.
Полиоксил 10 олеиловый эфир: Белая мягкая полутвердая или бледно-желтая жидкость со слабым запахом. Растворим в воде и спирте. Диспергируется в минеральном масле и пропиленгликоле с возможным разделением при стоянии. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полиоксил 15 гидроксистеарат: Восковая масса от желтовато-белого до белого цвета. Хорошо растворяется в воде; растворим в спирте и в 2-пропаноле; не растворим в минеральном масле. Он затвердевает при 25. Категория NF: лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент; средство (маслянистое).Полиоксил 20 цетостеариловый эфир: Кремовая, восковая маслянистая масса, тающая при нагревании в прозрачную коричневато-желтую жидкость. Растворим в воде, спирте и ацетоне; не растворим в растворителе гексане.Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полиоксил 35 касторовое масло: Желтая маслянистая жидкость со слабым характерным запахом и горьковатым вкусом. Очень растворим в воде, образуя практически бесцветный раствор без запаха; растворим в спирте и этилацетате; не растворяется в минеральных маслах. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полиоксил 40 гидрированное касторовое масло: Паста или пастообразная жидкость от белого до желтоватого цвета со слабым запахом и легким вкусом. Очень хорошо растворяется в воде, образуя раствор практически без вкуса, запаха и цвета; растворим в спирте и этилацетате; не растворяется в минеральных маслах. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полиоксил 40 стеарат: Восковое твердое вещество от белого до светло-коричневого.Без запаха или имеет слабый запах жира. Растворим в воде, спирте, эфире и ацетоне; не растворяется в минеральном масле и в растительных маслах. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полиоксилстеариловый эфир: От белого до желтовато-белого цвета, воскообразная маслянистая масса, гранулы, микрогранулы или хлопья. Полиоксилстеариловый эфир с 2 оксиэтиленовыми звеньями на молекулу растворим в спирте при нагревании и в хлористом метилене; практически не растворим в воде.Полиоксилстеариловый эфир с 10 оксиэтиленовыми звеньями на молекулу растворим в воде и спирте. Полиоксилстеариловый эфир с 20 оксэтиленовыми единицами на молекулу растворим в воде, спирте и метиленхлориде. После плавления он затвердевает примерно при 45 ° C.Полисорбат 20: Жидкость от лимонного до янтарного цвета со слабым характерным запахом. Растворим в воде, спирте, этилацетате, метаноле и диоксане; не растворим в минеральном масле. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полисорбат 40: Желтая жидкость со слабым характерным запахом. Растворим в воде и спирте; не растворяется в минеральном масле и в растительных маслах. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полисорбат 60: Маслянистая жидкость или полужель от лимонного до оранжевого цвета со слабым характерным запахом. Растворим в воде, этилацетате и толуоле; не растворяется в минеральном масле и в растительных маслах.Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Полисорбат 80: Маслянистая жидкость от лимонного до янтарного цвета со слабым характерным запахом и теплым, несколько горьковатым вкусом. Очень хорошо растворяется в воде, образуя практически бесцветный раствор без запаха; растворим в спирте и этилацетате; не растворим в минеральном масле. Категория NF: Эмульгирующий и / или солюбилизирующий агент; лубрикант для таблеток и / или капсул; смачивающий и / или солюбилизирующий агент.
Поливинилацетат: Белый или не совсем белый порошок или бесцветные гранулы или шарики. Легко растворим в этилацетате; растворим в спирте, ацетоне и хлороформе; практически не растворим в воде. Он гигроскопичен и разбухает в воде. Категория NF: Покрытие; осушитель; связующее для таблеток.
Дисперсия поливинилацетата: Непрозрачная, белая или не совсем белая слегка вязкая жидкость. Смешивается с водой и этанолом.Чувствителен к порче микробными загрязнителями. Категория NF: Покрытие.
Поливинилацетат фталат: Сыпучий белый порошок. Может иметь легкий запах уксусной кислоты. Растворим в метаноле и спирте; не растворим в воде, хлористом метилене и хлороформе. Категория NF: Покрытие.
Поливиниловый спирт: Гранулы от белого до кремового цвета или порошок от белого до кремового цвета.Без запаха. Легко растворим в воде при комнатной температуре. Раствор может происходить быстрее при несколько более высоких температурах. Категория NF: суспендирующий агент и / или агент, повышающий вязкость.
Сернистый калий: Кусочки неправильной формы, коричнево-коричневые, когда они только что приготовлены, становятся зеленовато-желтыми. Имеет запах сероводорода и горький, едкий и щелочной вкус. Разлагается на воздухе. Раствор (1 из 10) имеет светло-коричневый цвет и щелочной до лакмусовой кислоты.Легко растворяется в воде, обычно оставляет небольшой осадок. Спирт растворяет только сульфиды.
Ацетат калия: Бесцветные моноклинные кристаллы или белый кристаллический порошок, имеющий солевой и слегка щелочной вкус. Без запаха или имеет слабый уксусный запах. Делает вкус от влажного воздуха. Хорошо растворяется в воде; легко растворим в спирте.
Альгинат калия: Белый или желтый, волокнистый или гранулированный порошок.Растворяется в воде с образованием вязкого коллоидного раствора. не растворим в спирте и в водно-спиртовых растворах с содержанием спирта более 30% по весу; не растворим в хлороформе, эфире и кислотах с pH ниже примерно 3.
Бензоат калия: Белый гранулированный или кристаллический порошок без запаха или практически без запаха. Устойчив на воздухе. Легко растворим в воде; растворим в 90% спирте; Умеренно растворим в спирте. Категория NF: Противомикробный консервант.
Бикарбонат калия: Бесцветные прозрачные моноклинные призмы или белый гранулированный порошок. Без запаха, устойчив на воздухе. Его растворы нейтральны или щелочны по отношению к фенолфталеину TS. Легко растворим в воде; практически не растворим в спирте.
Битартрат калия: Бесцветные или слегка непрозрачные кристаллы или белый кристаллический порошок. Насыщенный раствор является лакмусовой кислотой. Растворим в кипящей воде; мало растворим в воде; очень мало растворим в спирте.
Бромид калия: Белый кристаллический порошок или бесцветные кубические кристаллы. Легко растворим в воде и глицерине; мало растворим в спирте.
Хлорид калия: Бесцветные, удлиненные, призматические или кубические кристаллы или белый гранулированный порошок. Не имеет запаха, имеет соленый вкус и стабилен на воздухе. Его растворы нейтральны к лакмусовой бумажке. Легко растворим в воде; не растворим в спирте.Категория NF: Тонизирующее средство.
Цитрат калия: Прозрачные кристаллы или белый гранулированный порошок. Не имеет запаха, имеет охлаждающий, соленый вкус и расплывается при контакте с влажным воздухом. Легко растворим в воде; очень мало растворим в спирте. Категория NF: Буферный агент.
Глюконат калия: От белого до желтовато-белого цвета, кристаллический порошок или гранулы. Не имеет запаха, имеет горьковатый привкус, стабилен на воздухе.Его растворы слабощелочные до лакмуса. Легко растворим в воде; практически не растворим в обезвоженном спирте, эфире, бензоле и хлороформе.
Гидроксид калия: Белые или практически белые, плавленые массы, или маленькие шарики, или хлопья, или палочки, или другие формы. Твердый и хрупкий, с кристаллическим изломом. На воздухе он быстро поглощает углекислый газ и влагу и расплывается. Хорошо растворяется в кипящем спирте; легко растворим в воде, спирте и глицерине.Категория NF: Подщелачивающий агент.
Йодистый калий: Гексаэдрические кристаллы, прозрачные и бесцветные, или несколько непрозрачные и белые, или белый гранулированный порошок. Немного гигроскопичен. Его растворы нейтральные или щелочные до лакмусовой бумажки. Очень хорошо растворяется в воде и еще больше растворяется в кипящей воде; легко растворим в глицерине; растворим в спирте.
Пероральный раствор йодида калия: Прозрачная, бесцветная жидкость без запаха, имеющая характерный, сильно соленый вкус.Является нейтральным или щелочным по отношению к лакмусовой бумаге. Удельный вес около 1,70.
Метабисульфит калия: Белые или бесцветные, сыпучие кристаллы, кристаллический порошок или гранулы, обычно имеющие запах диоксида серы. Постепенно окисляется на воздухе до сульфата. Его растворы кислые до лакмусовой бумажки. Растворим в воде; не растворим в спирте. Категория NF: Антиоксидант.
Метафосфат калия: Белый порошок без запаха.Растворим в разбавленных растворах солей натрия; не растворим в воде. Категория NF: Буферный агент.
Азотнокислый калий: Белый кристаллический порошок или бесцветные кристаллы. Хорошо растворяется в кипящей воде; свободно растворяется в воде; растворим в глицерине; практически не растворим в спирте.
Перманганат калия: Темно-пурпурные кристаллы, почти непрозрачные в проходящем свете и имеющие синий металлический блеск в отраженном свете.Его цвет иногда изменяется, приобретая темный бронзовый оттенок. Устойчив на воздухе. Легко растворим в кипящей воде; растворим в воде.
Двухосновный фосфат калия: Бесцветный или белый, несколько гигроскопичный, гранулированный порошок. PH раствора (1 из 20) составляет от 8,5 до 9,6. Легко растворим в воде; очень мало растворим в спирте. Категория NF: Буферный агент.
Одноосновный фосфат калия: Бесцветные кристаллы или белый гранулированный или кристаллический порошок.Без запаха, устойчив на воздухе. PH раствора (1 из 100) составляет около 4,5. Легко растворим в воде; практически не растворим в спирте. Категория NF: Буферный агент.
Тартрат калия и натрия: Бесцветные кристаллы или белый кристаллический порошок, имеющий охлаждающий соленый вкус. Поскольку в теплом сухом воздухе кристаллы слегка выцветают, они часто покрываются белым порошком. Легко растворим в воде; практически не растворим в спирте.
Сорбат калия: Белые кристаллы или порошок с характерным запахом.Плавится при температуре около 270 ° С с разложением. Легко растворим в воде; растворим в спирте. Категория NF: Противомикробный консервант.Повидон: Порошок от белого до слегка кремово-белого цвета. Гигроскопичен. Легко растворим в воде, метаноле и спирте; мало растворим в ацетоне; практически не растворим в эфире. Категория NF: суспендирующий агент и / или агент, повышающий вязкость; связующее для таблеток.
Повидон-Йод: Аморфный порошок от желтовато-коричневого до красновато-коричневого цвета со слабым характерным запахом.Его раствор кислотен для лакмусовой бумажки. Растворим в воде и спирте; практически нерастворим в хлороформе, четыреххлористом углероде, эфире, растворителе гексане и ацетоне.
Повидон-йодный аэрозольный раствор для местного применения: Жидкость, полученная из раствора повидон-йода для местного применения, прозрачна и имеет красновато-коричневый цвет.
Пралидоксима хлорид: Кристаллический порошок от белого до бледно-желтого цвета.Не имеет запаха и стабилен на воздухе. Легко растворим в воде.
Прамипексола дигидрохлорид: Кристаллический порошок от белого до почти белого цвета. Легко растворим в воде; растворим в метаноле; мало растворим в спирте; практически не растворяется в хлористом метилене.
Прамоксина гидрохлорид: От белого до практически белого кристаллического порошка, имеющего привкус онемения. Может иметь легкий ароматный запах. PH раствора (1 из 100) составляет около 4.5. Легко растворим в воде и спирте; растворим в хлороформе; очень мало растворим в эфире.
Правастатин натрия: Гигроскопичный порошок от белого до желтовато-белого цвета. Легко растворим в воде и метаноле; растворим в обезвоженном спирте; практически не растворим в ацетонитриле и хлороформе.
Празиквантел: Белый или практически белый кристаллический порошок; без запаха или со слабым характерным запахом.Легко растворим в спирте и хлороформе; очень мало растворим в воде.
Празозина гидрохлорид: Пудра от белого до коричневого цвета. Слабо растворим в воде, метаноле, диметилформамиде и диметилацетамиде; очень мало растворим в спирте; практически не растворим в хлороформе и ацетоне.
Предникарбат: Белый или почти белый кристаллический порошок. Легко растворим в ацетоне и спирте; трудно растворим в пропиленгликоле; практически не растворим в воде.
Преднизолон: Кристаллический порошок от белого до практически белого цвета, без запаха. Плавится при температуре около 235 ° С с некоторым разложением (см. «Диапазон плавления или температура 741»). Растворим в метаноле и диоксане; трудно растворим в ацетоне и спирте; мало растворим в хлороформе; очень мало растворим в воде. Преднизолона ацетат: Кристаллический порошок от белого до практически белого цвета, без запаха. Плавится при температуре около 235 ° С с некоторым разложением (см. «Диапазон плавления или температура 741»). Слабо растворим в ацетоне, спирте и хлороформе; практически не растворим в воде.Преднизолона Гемисукцинат: Мелкий кремово-белый порошок с рыхлыми комочками; практически без запаха. Плавится примерно при 205 ° С с разложением. Легко растворим в спирте; растворим в ацетоне; очень мало растворим в воде.Преднизолон натрия фосфат: Белые или слегка желтые, рыхлые гранулы или порошок. Без запаха или имеет легкий запах. Немного гигроскопичен. Легко растворим в воде; растворим в метаноле; мало растворим в спирте и хлороформе; очень мало растворим в ацетоне и диоксане.
Преднизолон натрия сукцинат для инъекций: Кремово-белый порошок с рыхлыми комочками, имеющий легкий запах.
Преднизолона Тебутат: Легкосыпучий порошок от белого до слегка желтоватого цвета, на котором могут образовываться небольшие комочки. Без запаха или имеет умеренный характерный запах. Гигроскопичен. Легко растворим в хлороформе и диоксане; растворим в ацетоне; трудно растворим в спирте и метаноле; очень мало растворим в воде.
Преднизон: Кристаллический порошок от белого до практически белого цвета, без запаха. Плавится при температуре около 230 ° C с некоторым разложением (см. «Диапазон плавления или температура 741»). Слабо растворим в спирте, хлороформе, диоксане и метаноле; очень мало растворим в воде.Прилокаин: Белый или почти белый порошок или агрегаты кристаллов. Хорошо растворим в спирте и ацетоне; мало растворим в воде.
Прилокаина гидрохлорид: Белый кристаллический порошок без запаха, горький на вкус.Легко растворим в воде и спирте; мало растворим в хлороформе; очень мало растворим в ацетоне; практически не растворим в эфире.
Примахин фосфат: Оранжево-красный кристаллический порошок. Без запаха и горького вкуса. Его растворы кислые до лакмусовой бумажки. Плавится при температуре около 200. Растворим в воде; не растворим в хлороформе и эфире.Примидон: Белый кристаллический порошок. Без запаха и немного горьковатого вкуса. Слабо растворим в спирте; очень мало растворим в воде и в большинстве органических растворителей.
Пробукол: Кристаллический порошок от белого до кремового цвета. Легко растворим в хлороформе и н-пропиловом спирте; растворим в спирте и растворителе гексане; не растворим в воде.
Пробенецид: Белый или практически белый мелкокристаллический порошок. Практически без запаха. Растворим в разбавленной щелочи, в хлороформе, спирте и ацетоне; практически не растворим в воде и разбавленных кислотах.
Прокаинамида гидрохлорид: Кристаллический порошок от белого до коричневого цвета.Без запаха. Его раствор (1 из 10) имеет pH от 5 до 6,5. Хорошо растворяется в воде; растворим в спирте; мало растворим в хлороформе; очень мало растворим в бензоле и эфире.
Прокаинамид гидрохлорид для инъекций: Бесцветный или имеющий не более легкий желтый цвет.
Прокаина гидрохлорид: Маленькие белые кристаллы или белый кристаллический порошок. Без запаха. При нанесении на язык проявляет местные анестезирующие свойства.Легко растворим в воде; растворим в спирте; мало растворим в хлороформе; практически не растворим в эфире.
Инъекции прокаина гидрохлорида: Прозрачная бесцветная жидкость.
Прохлорперазин: Прозрачная бледно-желтая вязкая жидкость. Чувствителен к свету. Легко растворим в спирте, хлороформе и эфире; очень мало растворим в воде.
Прохлорперазина Эдисилат: Кристаллический порошок от белого до очень светло-желтого цвета без запаха.Его растворы кислые до лакмусовой бумажки. Легко растворим в воде; очень мало растворим в спирте; не растворим в эфире и в хлороформе.
Прохлорперазина малеат: Белый или бледно-желтый кристаллический порошок практически без запаха. Его насыщенный раствор кислотен по лакмусовой бумаге. Слабо растворим в теплом хлороформе; практически не растворим в воде и спирте.
Проциклидин гидрохлорид: Белый кристаллический порошок с умеренным характерным запахом.Плавится примерно при 225 ° C с разложением. Растворим в воде и спирте; не растворим в эфире и в ацетоне.Прогестерон: Белый или кремово-белый кристаллический порошок без запаха. Устойчив на воздухе. Растворим в спирте, ацетоне и диоксане; трудно растворим в растительных маслах; практически не растворим в воде.
Прогуанила гидрохлорид: Белый кристаллический порошок. Умеренно растворим в спирте; мало растворим в воде; практически не растворяется в хлористом метилене.
Пролин: Белые кристаллы без запаха, слегка сладковатые. Легко растворим в воде и в абсолютном спирте; не растворим в эфире, бутаноле и изопропаноле.
Промазина гидрохлорид: Кристаллический порошок от белого до слегка желтоватого цвета, практически без запаха. При длительном контакте с воздухом окисляется и приобретает голубой или розовый цвет. Легко растворим в воде и хлороформе.
Прометазина гидрохлорид: Кристаллический порошок от белого до бледно-желтого цвета, практически без запаха.Медленно окисляется и при длительном контакте с воздухом приобретает синий цвет. Легко растворим в воде, горячем обезвоженном спирте и хлороформе; практически не растворим в эфире, ацетоне и этилацетате.
Пропафенона гидрохлорид: Белый порошок. Растворим в метаноле и в горячей воде; мало растворим в спирте и хлороформе; очень мало растворим в ацетоне; не растворим в диэтиловом эфире и в толуоле.
Пропантелин бромид: Белые или практически белые кристаллы.Без запаха и горького вкуса. Плавится около 160, с разложением. Хорошо растворим в воде, спирте и хлороформе; практически не растворим в эфире и в бензоле.Пропаракаина гидрохлорид: Кристаллический порошок от белого до кремового или светло-желтого цвета без запаха. Его растворы нейтральны к лакмусовой бумажке. Растворим в воде, теплом спирте и метаноле; не растворим в эфире и в бензоле.
Офтальмологический раствор пропаракаина гидрохлорида: Бесцветный или бледно-желтый раствор.
Пропионовая кислота: Маслянистая жидкость со слабым резким прогорклым запахом. Смешивается с водой, спиртом и различными другими органическими растворителями. Категория NF: Подкислитель.
Пропофол: Прозрачная бесцветная или слегка желтоватая жидкость. Хорошо растворим в метаноле и этаноле; мало растворим в циклогексане и изопропиловом спирте; очень мало растворим в воде.
Пропоксикаина гидрохлорид: Белое кристаллическое вещество без запаха, обесцвечивающееся при длительном воздействии света и воздуха.PH раствора (1 из 50) составляет около 5,4. Легко растворим в воде; растворим в спирте; трудно растворим в эфире; практически не растворим в ацетоне и хлороформе.
Пропоксифена гидрохлорид: Белый кристаллический порошок. Без запаха и горького вкуса. Легко растворим в воде; растворим в спирте, хлороформе и ацетоне; практически не растворим в бензоле и эфире.
Напсилат пропоксифена: Белый порошок, практически не имеющий запаха, но имеющий горький вкус.Растворим в метаноле, спирте, хлороформе и ацетоне; очень мало растворим в воде.
Пропранолола гидрохлорид: Кристаллический порошок от белого до кремового цвета. Без запаха и горького вкуса. Плавится примерно при 164. Растворим в воде и спирте; мало растворим в хлороформе; практически не растворим в эфире.Пропилгаллат: Белый кристаллический порошок с очень слабым характерным запахом. Легко растворим в спирте; мало растворим в воде.Категория NF: Антиоксидант.
Пропиленгликоль: Прозрачная бесцветная вязкая жидкость с легким характерным вкусом. Практически без запаха. Поглощает влагу при контакте с влажным воздухом. Смешивается с водой, ацетоном и хлороформом. Растворим в эфире и растворяет многие эфирные масла, но не смешивается с жирными маслами. Категория NF: увлажнитель; пластификатор; растворитель.
Альгинат пропиленгликоля: Волокнистый или гранулированный порошок от белого до желтоватого цвета.Практически без запаха и вкуса. Растворим в воде, растворах разбавленных органических кислот и, в зависимости от степени этерификации, в водно-спиртовых смесях, содержащих до 60 мас.% Спирта, с образованием стабильных вязких коллоидных растворов при pH 3. Категория NF: суспендирование и / или агент, повышающий вязкость.
Дикаприлат / дикапрат пропиленгликоля: Прозрачная, бесцветная или слегка желтоватая маслянистая жидкость при 20. Растворим в жирных маслах и легком вазелине; слабо растворяется в обезвоженном спирте; практически не растворим в воде.Категория NF: Эмульгирующий и / или солюбилизирующий агент; средство передвижения. Дилаурат пропиленгликоля: Прозрачная маслянистая жидкость при 20. Бесцветная или слегка желтоватая. Хорошо растворим в спирте, метаноле и хлористом метилене; практически не растворим в воде. Монокаприлат пропиленгликоля: Прозрачная, бесцветная или слегка желтоватая маслянистая жидкость при температуре 20. Хорошо растворима в спирте, хлороформе и метиленхлориде; практически не растворим в воде. Категория NF: Эмульгирующий и / или солюбилизирующий агент; разбавитель для таблеток и / или капсул; средство передвижения.Монолаурат пропиленгликоля: Прозрачная маслянистая жидкость при 20. Бесцветная или слегка желтоватая. Хорошо растворим в спирте, метаноле и хлористом метилене; практически не растворим в воде.Моностеарат пропиленгликоля: Белое, воскообразное твердое вещество или в виде белых воскообразных шариков или хлопьев. Имеет легкий приятный жирный запах и вкус. Растворим в органических растворителях, таких как спирт, минеральные или жирные масла, бензол, эфир и ацетон; не растворим в воде, но может быть диспергирован в горячей воде с помощью небольшого количества мыла или другого подходящего поверхностно-активного агента.Категория NF: Эмульгирующий и / или солюбилизирующий агент.
Пропилгекседрин: Прозрачная бесцветная жидкость с характерным аминоподобным запахом. Медленно улетучивается при комнатной температуре. Поглощает углекислый газ из воздуха, а его растворы щелочные до лакмусовой бумажки. Температура кипения около 205. Очень мало растворим в воде. Смешивается со спиртом, хлороформом и эфиром.Пропилиодон: Белый или почти белый кристаллический порошок. Без запаха или имеет слабый запах.Растворим в ацетоне, спирте и эфире; практически не растворим в воде.
Пропилпарабен: Мелкие бесцветные кристаллы или белый порошок. Легко растворим в спирте и эфире; слабо растворяется в кипящей воде; очень мало растворим в воде. Категория NF: Противомикробный консервант.
Пропилпарабен натрия: Белый порошок. Не имеет запаха и гигроскопичен. Легко растворим в воде; трудно растворим в спирте; не растворим в жирных маслах.Категория NF: Противомикробный консервант.
Пропилтиоурацил: Белое порошкообразное кристаллическое вещество. По виду и на ощупь похож на крахмал, имеет горький вкус. Растворим в гидроксиде аммония и гидроксидах щелочных металлов; трудно растворим в спирте; мало растворим в воде, хлороформе и эфире.
Инъекции сульфата протамина: Бесцветный раствор, который может иметь запах консерванта.
Сульфат протамина для инъекций: Белый порошок без запаха, имеющий характерный вид твердых веществ, высушенных из замороженного состояния.
Инъекции протеинового гидролизата: Прозрачная жидкость от желтоватого до красновато-янтарного цвета.
Протриптилин гидрохлорид: Порошок от белого до желтоватого цвета. Без запаха или имеет лишь легкий запах. Плавится при температуре около 168. Легко растворим в воде, спирте и хлороформе; практически не растворим в эфире.Псевдоэфедрина гидрохлорид: Мелкие кристаллы или порошок от белого до кремового цвета со слабым характерным запахом. Хорошо растворяется в воде; легко растворим в спирте; мало растворим в хлороформе.
Сульфат псевдоэфедрина: Белые кристаллы или кристаллический порошок. Без запаха. Легко растворим в спирте.
Пуллулан: Белый порошок. Легко растворим в воде; практически не растворяется в обезвоженном спирте.Категория NF: Наполнитель для сублимационной сушки; покрывающий агент; пластификатор; полимерная мембрана; секвестрирующий агент; суспендирующий и / или повышающий вязкость агент; связующее для таблеток; разбавитель для таблеток и / или капсул; таблеточный разрыхлитель; смачивающий и / или солюбилизирующий агент.
Пемза: Очень легкие, твердые, грубые, пористые, сероватые массы или зернистый сероватый порошок. Без запаха и вкуса, устойчив на воздухе. Практически не растворим в воде; не подвергается воздействию кислот.
Пирантел Памоат: От желтого до коричневого твердого вещества. Растворим в диметилсульфоксиде; слабо растворяется в диметилформамиде; практически не растворим в воде и метаноле.
Пиразинамид: Белый или практически белый кристаллический порошок без запаха или практически без запаха. Умеренно растворим в воде; слабо растворим в спирте, эфире и хлороформе.
Экстракт пиретрума: Бледно-желтая жидкость с мягким цветочным запахом.Растворим в минеральном масле и большинстве органических растворителей; не растворим в воде. Пиретрины I обозначают группу, содержащую пиретрин 1, цинерин 1 и жасмолин 1; Пиретрины II обозначают группу, содержащую пиретрин 2, цинерин 2 и жасмолин 2.
Пиридостигмина бромид: Белый или практически белый кристаллический порошок с приятным характерным запахом. Гигроскопичен. Легко растворим в воде, спирте и хлороформе; мало растворим в растворителе гексане; практически не растворим в эфире.
Пиридоксина гидрохлорид: От белого до практически белого цвета кристаллы или кристаллический порошок. Устойчив на воздухе, на него медленно влияют солнечные лучи. Его растворы имеют pH около 3. Легко растворим в воде; мало растворим в спирте; нерастворим в эфире.
Пириламин малеат: Белый кристаллический порошок, обычно со слабым запахом. Его растворы кислые до лакмусовой бумажки. Хорошо растворяется в воде; легко растворим в спирте и хлороформе; мало растворим в эфире и в бензоле.
Пириметамин: Белый кристаллический порошок без запаха. Слабо растворим в ацетоне, спирте и хлороформе; практически не растворим в воде.
Пирвиния памоат: Кристаллический порошок от ярко-оранжевого или оранжево-красного до практически черного цвета. Легко растворим в ледяной уксусной кислоте; слабо растворим в хлороформе и метоксиэтаноле; очень мало растворим в метаноле; практически не растворим в воде и эфире.
Пероральная суспензия пирвиния памоата: Темно-красная непрозрачная суспензия по существу очень мелких аморфных частиц или агрегатов, обычно размером менее 10 мкм. Также могут присутствовать более крупные частицы, некоторые из которых могут быть кристаллами, размером до 100 мкм.

 М.П.)
М.П.) Реагирует с сильными окислителями, сильными кислотами и сильными основаниями. Это создает опасность пожара и взрыва.
Реагирует с сильными окислителями, сильными кислотами и сильными основаниями. Это создает опасность пожара и взрыва.
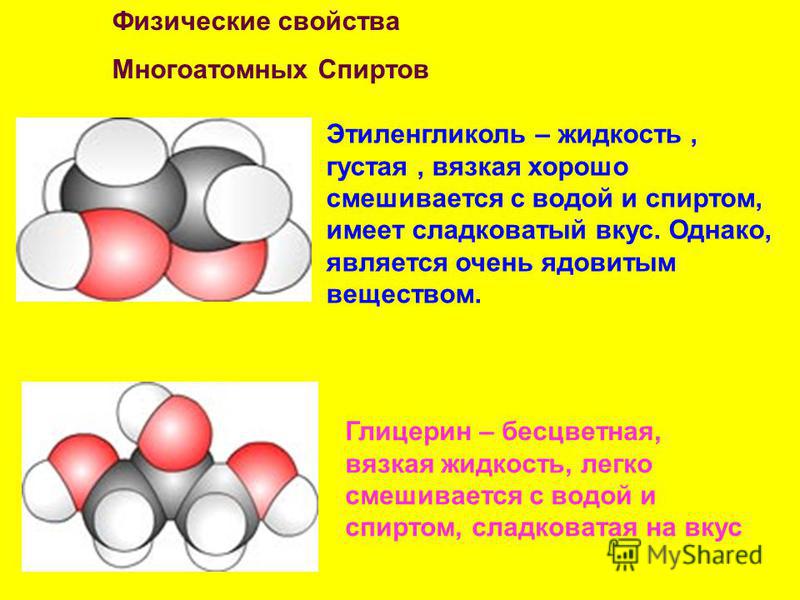 Это, в свою очередь, заставляет кислород нести частичный отрицательный заряд (δ-), а водород — частичный положительный заряд (δ +). Поскольку противоположные заряды притягиваются друг к другу, это означает, что молекулы этиленгликоля притягиваются друг к другу, что затрудняет их разъединение (подумайте о « молекулярной липучке »), а это, в свою очередь, делает его точку кипения выше, чем у углеводородов. аналогичная масса.
Это, в свою очередь, заставляет кислород нести частичный отрицательный заряд (δ-), а водород — частичный положительный заряд (δ +). Поскольку противоположные заряды притягиваются друг к другу, это означает, что молекулы этиленгликоля притягиваются друг к другу, что затрудняет их разъединение (подумайте о « молекулярной липучке »), а это, в свою очередь, делает его точку кипения выше, чем у углеводородов. аналогичная масса. 07
07 Проблема сначала возникла в Панаме, но затем распространилась.Поддельная зубная паста Colgate , содержащая ДЭГ, была обнаружена в продаже в некоторых частях США, в то время как поддельная зубная паста Sensodyne была обнаружена в Англии. В какой-то момент FDA запретило производство всех зубных паст китайского производства в США. В период с 1 июня по 22 октября 2006 года в Панаме произошло 119 случаев отравления ДЭГ, 78 из которых погибли из-за сиропа от кашля местного производства, не содержащего сахара.
Проблема сначала возникла в Панаме, но затем распространилась.Поддельная зубная паста Colgate , содержащая ДЭГ, была обнаружена в продаже в некоторых частях США, в то время как поддельная зубная паста Sensodyne была обнаружена в Англии. В какой-то момент FDA запретило производство всех зубных паст китайского производства в США. В период с 1 июня по 22 октября 2006 года в Панаме произошло 119 случаев отравления ДЭГ, 78 из которых погибли из-за сиропа от кашля местного производства, не содержащего сахара. petresin.org/news_introtoPET.asp (информационный бюллетень по полиэтилентерефталату)
petresin.org/news_introtoPET.asp (информационный бюллетень по полиэтилентерефталату)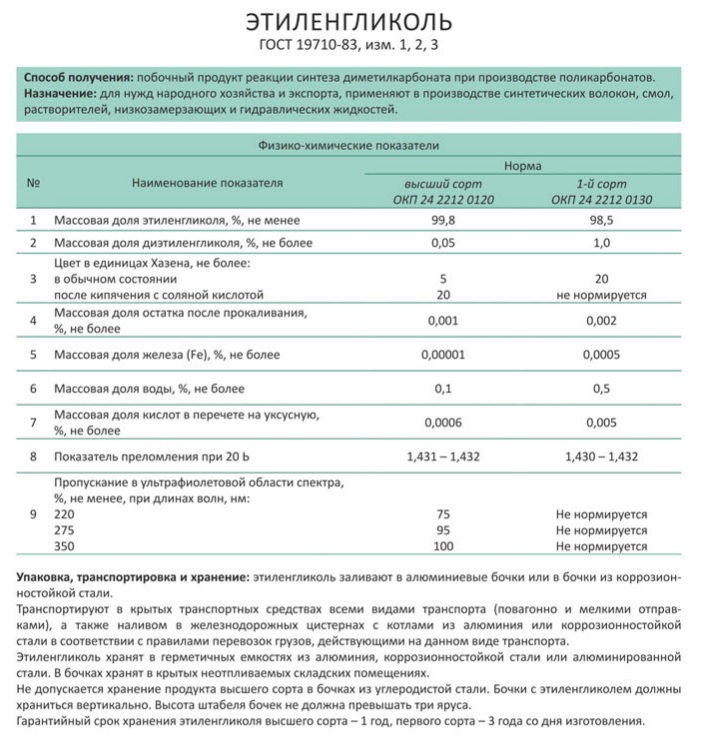 Brent, Drugs , 2001, 61 , 979-988 (Управление отравлением этиленгликолем)
Brent, Drugs , 2001, 61 , 979-988 (Управление отравлением этиленгликолем) М. К. Гейлинг и П. Р. Кэннон, JAMA . 1938, 111 , 919-926 (смерть от сульфаниламидного эликсира в США)
М. К. Гейлинг и П. Р. Кэннон, JAMA . 1938, 111 , 919-926 (смерть от сульфаниламидного эликсира в США) Эрнандес, М. Ибаньес и Х. В. Санчо, Anal. Bioanal Chem. , 2008, 391 , 1021–1027 (обнаружение ДЭГ в зубной пасте)
Эрнандес, М. Ибаньес и Х. В. Санчо, Anal. Bioanal Chem. , 2008, 391 , 1021–1027 (обнаружение ДЭГ в зубной пасте) плюс история массовых отравлений ДЭГ)
плюс история массовых отравлений ДЭГ) Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
 [4]
[4]  Избранная информация о токсичности из HSDB.
Избранная информация о токсичности из HSDB.