Этандиол структурная формула: Этандиол-1,1, структурная формула, химические свойства
Этандиол-1,1, структурная формула, химические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Этиленгликоль, структурная формула, химические, физические свойства
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Этандиол — Справочник химика 21
Этандиол-1,2, этиленгликоль, получают гидролизом этилен-оксида [c.262]Этиленгликоль (по заместительной номенклатуре — этандиол-1,2) — сиропообразная жидкость сладкого вкуса, без запаха, ядовит. Хорошо смешивается с водой и спиртом, гигроскопичен. Его структурная формула [c.314]
С,НаОа Этандиол-1. 2 (этиленгликоль) [c.363]
В каждом ряду расположите спирты в порядке уменьшения их кислотности а) 1-пропанол, 2-пропанол, 2-метил-2-про-ланол б) этанол, 1,2-этандиол, 1,2,3-пропантриол. [c.53]
Полиэфирные смолы — примером их может быть продукт поликонденсации терефталевой кислоты с этандиолом [c.381]
Напишите формулы следующих двухатомных спиртов а) метандиол б) 1,2-этандиол (этиленгликоль) в ) 1,1-этандиол г) 1,3-пропандиол д) 1,1-пропанднол е ) 2,2-пропандиол ж) 2,3-диметил-2,3-бутандиол з) 1,5-пентандиол.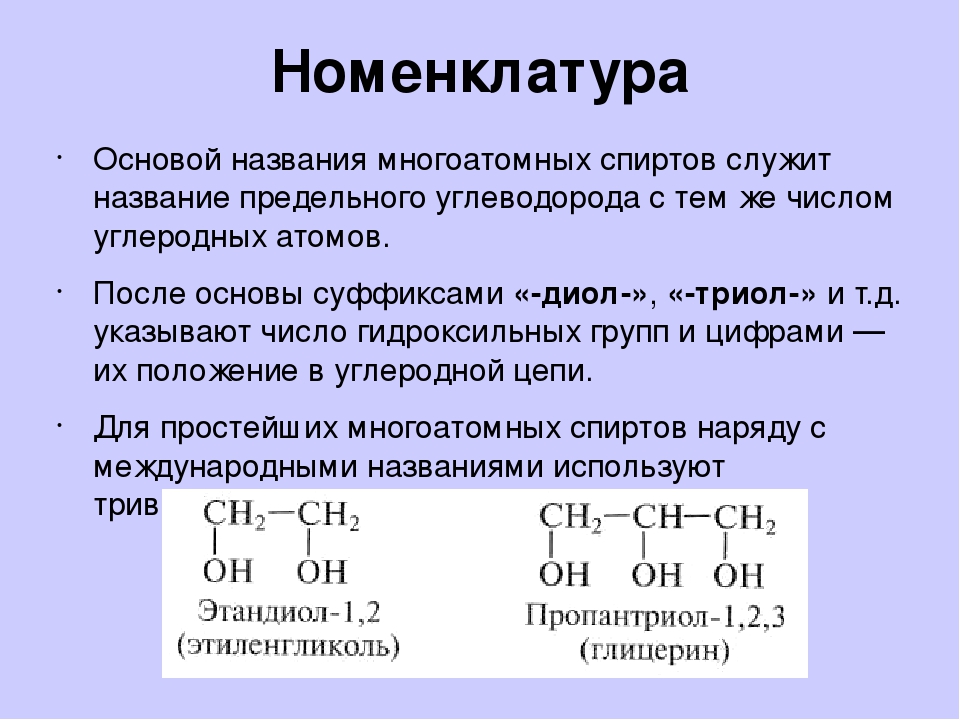 Какие из них неустойчивы и в свободном виде не существуют Что с ними происходит в момент образования Напишите схемы превращений. [c.37]
Какие из них неустойчивы и в свободном виде не существуют Что с ними происходит в момент образования Напишите схемы превращений. [c.37]
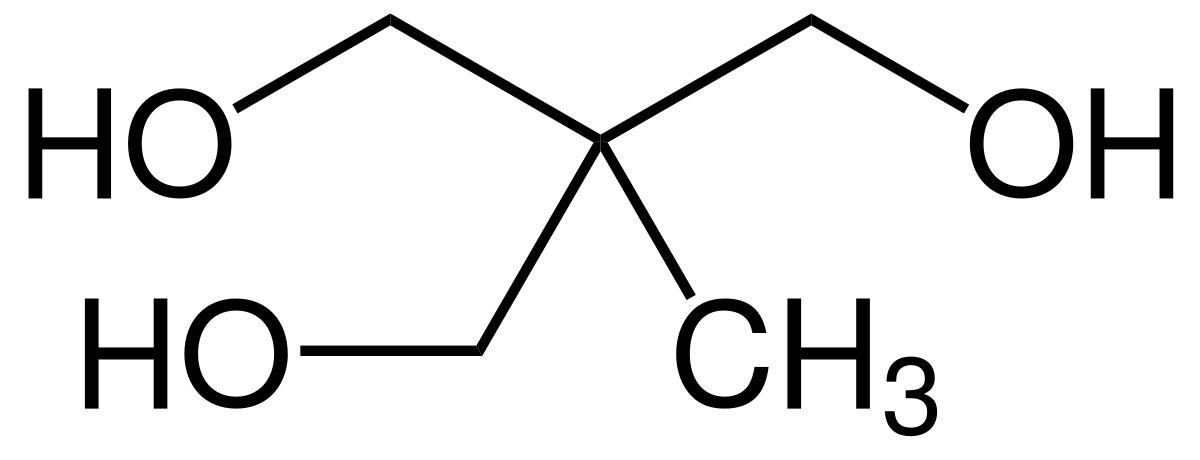
Поэтому первым представителем двухатомных спиртов является производное этана состава С2Н4(ОН)2 с гидроксильными группами при различных углеродных атомах—этандиол-1,2, который также называют этиленгликолем, или просто гликолем. Пропану соответствуют уже два двухатомных спирта — пропандиол-1,2, или пропиленгликоль, и пропандиол-1,3, или триметиленгликоль СИг-СН., Hj- H-СНз СНа-СНг-СНг [c.120]
Напишите реакции этиленгликоля (1,2-этандиола) со следующими реагентами а) Ыа б) НВг в) СН3СООН [Н+1 г) НЫОз [c.55]
Метиловый спирт Этиловый спирт Пропиловый спирт Изопропиловый спирт Бутиловый спирт Изобутиловый спирт Третичный бутиловый спирт Этиленгликоль Метанол Этанол Пропан-1-ол Пропан-2-ол Бутан-1-ол Бутан-2-ол 2метил пропан-2-ол Этандиол Метанол Этанол 1-пропанол 2-пропанол 1-бутанол 2-бутанол Третичный бутиловый спирт Этиленгликоль [c. 377]
377]
Например, при пропускании этилена через раствор КМпОд образуется двухатомный спирт — этандиол-1,2 (этиленгликоль). Раствор при этом обесцвечивается, поэтому данная реакция используется как качественная для обнаружения двойных углерод-углеродных связей [c.333]
Этиленгликоль (этандиол) СН2ОН—СНгОН — бесцветная вязкая жидкость, растворимая в воде и многих органических растворителях (спирте, ацетоне и др.). Этиленгликоль обладает более кислыми свойствами, чем этиловый спирт. Широко используется в химической промышленности. Водные растворы этиленгликоля применяются в качестве антифризов (незамерзающих при низкой температуре жидкостей) для охлаждения автомобильных двигателей в зимний период. Например, 50%-ный водный раствор этиленгликоля замерзает только при —34°С. [c.121]
По женевской номенклатуре к названию соответствующего предельного углеводорода прибавляется окончание диол и цифрами указывается положение гидроксильных групп. Например, гликоль по женевской номенклатуре будет называться этандиол-1,2. [c.110]
Например, гликоль по женевской номенклатуре будет называться этандиол-1,2. [c.110]
Напишите структурные формулы каждого из следующих соединений а) 2-бута-нол б) 1,2-этандиол в) метилформиат г) ди-этилкетон д) диэтиловый эфир. [c.439]
Приведите структурные формулы двухатомных спиртов (гликолей) этандиола-1,2, пропандиола-1,2, бу-тандиола-1,4, 2,3-диметилбутандиола-2,3. [c.46]
Этандиол-1,2 Этиленгли- коль НО—СНгСНа—ОН 62,10 1108 [c.52]
Смесь компонентов 3.5-Диоксагептандиол-1,7-ацетат Этандиол-1,2-диацетат 3.5-Д иоксагептаидиол -1,7-диацетат 1,3-Диоксолан Диэтилформаль Этилацетат [c.90]
Номенклатура. Этиленгликоль — двухатомный спирт. По женевской номенклатуре название двухатомных спиртов образуется так же, как и одноатомных, но перед характерным для спиртов окончанием ол ставят греческое числительное, обозначающее число гидроксогрупп.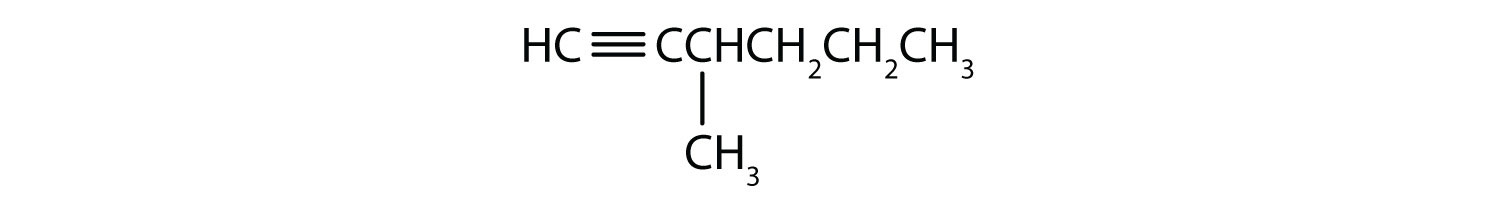 Названия двухатомных спиртов имеют окончание диол , трехатомных — триол и т. д. После этих окончаний цифрами указываются положения гидроксидов в углеродной цепи. Первым представителем двухатомных спиртов является производное этана состава С2Н4(ОН)2 с гидроксогруппами при различных углеродных атомах — этандиол-1, 2. Его называют этиленгликолем или просто гликолем. Структурная.формул,а [c.333]
Названия двухатомных спиртов имеют окончание диол , трехатомных — триол и т. д. После этих окончаний цифрами указываются положения гидроксидов в углеродной цепи. Первым представителем двухатомных спиртов является производное этана состава С2Н4(ОН)2 с гидроксогруппами при различных углеродных атомах — этандиол-1, 2. Его называют этиленгликолем или просто гликолем. Структурная.формул,а [c.333]
Основы неорганической химии для студентов нехимических специальностей (1989) — [ c.80 ]
Органические реакции Сб 8 (1956) — [ c.2 , c.11 ]
Общая органическая химия Т.10 (1986) — [ c.683 , c.686 ]
Справочник биохимии (1991) — [ c.2 , c.54 ]
Жидкостная колоночная хроматография том 3 (1978) — [
c. 2
,
c.2
,
c.26
]
2
,
c.2
,
c.26
]
Общая органическая химия Том 2 (1982) — [ c.2 , c.121 , c.294 , c.408 , c.509 ]
Вредные органические соединения в промышленных сточных водах 1982 (1982) — [ c.202 ]
Общая органическая химия Т6 (1984) — [ c.516 ]
Курс органической химии (1979) — [ c.161 ]
Реактивы и препараты для микроскопии (1980) — [ c.2 , c.458 ]
Курс органической химии (1970) — [ c.113 ]
общая органическая химия Том 2 (1982) — [
c. 2
,
c.121
,
c.294
,
c.408
,
c.509
]
2
,
c.121
,
c.294
,
c.408
,
c.509
]
Органическая химия (1962) — [ c.87 ]
Химия органических лекарственных препаратов (1949) — [ c.2 , c.91 ]
Курс органической и биологической химии (1952) — [ c.75 ]
Курс органической химии _1966 (1966) — [ c.119 ]
Органическая химия Издание 4 (1970) — [ c.79 ]
Курс органической химии (0) — [ c.176 ]
Применение биохимического методы для очистки сточных вод (0) — [
c.2
,
c. 81
]
81
]
формула, свойства, получение, применение и класс опасность
Глицерин и этиленгликоль (ethylene glycol) являются самыми известными химическими веществами, которые применяют в различных сферах деятельности. Их исследование несколько веков назад показало, что схожих веществ не существует. Многоатомные спирты используют и в химических синтезах, и в отраслях промышленности, и в сферах человеческой деятельности.
Однако эти вещества имеют и отрицательные качества. Поэтому стоит тщательно разобрать состав этиленгликоля, его формулу и степень опасности для человека.
Что такое этиленгликоль
По определению этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2) — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель многоатомных спиртов. Если вещество очищено, то представляет собой прозрачную бесцветную жидкость маслянистой консистенции.
Изначально этиленгликоль использовался во времена Первой мировой войны в качестве глицерина. Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Однако со временем изменил свое направление. Его стали использовать в различных сферах химической промышленности.
Формула и класс вещества
Химическая формула гликоля — C2H6O2, рациональная — C2h5 (OH) 2, структурная — HO—Ch3—Ch3—OH . В основе молекулы лежит непредельный скелет этилена, который состоит из двух атомов карбона. На свободные валентные места присоединились две гидроксильные группы.
У этиленгликоля есть несколько названий, которые зачастую встречаются в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Молекула имеет подобие транс-конфигурации в размещении гидроксильных групп. Такое расположение соответствует самому удаленному расположению водородов, что дает максимальную устойчивость системы.
Как получают
Массовое получение 1.2-этандиола началось еще в тридцатые годы прошлого века. Сначала получали лишь одним методом, потом появились новые. Таким образом, гликоль можно получить несколькими способами, однако некоторые из них стали частью истории, а другие превзошли их качеством.
Изначально 1,2-диоксиэтан получали из дибромэтана. Двойная связь этилена разрывается, а свободные валентности занимаются галогенами — исходным веществом в данной реакции. Образование промежуточного соединения возможно благодаря замещению ацетатными группами, которые при гидролизе превращаются в спиртовые.
С улучшением технологий появился новый метод — получение этиленгликоля прямым гидролизом любых этанов и этиленов , которые замещены двумя галогенами соседних атомов карбона. С помощью различных водных растворов, карбонатов металлов, воды и диоксида свинца начинается реакция, которая возможна лишь при больших температурах и давлении. Побочные вещества — диэтиленгликоль и триэтиленгликоль.
Следующий способ позволил получать 1,2-диоксиэтан из эфира этиленхлоргидрина путем его гидролиза угольными солями. При 170 градусах выход целевого продукта достигал 90 %. Однако был значительный недостаток — гликоль необходимо извлекать из раствора соли. Ученые решили эту проблему. Они разбили процесс на две стадии, при этом оставив то же исходное вещество.
Гидролиз этиленгликоль ацетатов стал отдельным способом, когда получилось добыть исходный реагент путем окисления этилена в уксусной кислоте кислородом.
Свойства
1,2-диоксиэтан не имеет запаха, однако, имеет сладковатый вкус. Относят к умеренно токсичным легковоспламеняющимся веществам. Легко соединяется с водой. Это используют в промышленности, так как температура замерзания таких веществ очень низкая.
Физические
Еще в прошлом веке стало известно, что этиленгликоль обладает уникальными свойствами.
Характеристики:
- температура возгорания составляет от +112 ˚С до +124 ˚С;
- самовоспламениться может при нагреве до +380 ˚С;
- чистый этиленгликоль замерзает при -12 ˚С;
- раствор на водной основе может замерзать при температуре ниже -65 ˚С, а при более низком значении начинается образование кристаллов льда;
- точка кипения чистой жидкости достигается при +121 ˚С;
- плотность — 11,114 г/см³.

Такие характеристики дают возможность применять 1,2-диоксиэтан в различных сферах производства.
Химические
Вещество имеет несколько названий, но все они означают одно и то же. Собственно, и химические свойства у них одинаковы. Если массовая доля вещества достигает 99.8%, то оно высшего сорта.
Список химических свойств:
- молярная масса — 62,068 г/моль;
- коэффициент оптического преломления — 1,4318;
- константа диссоциации кислоты — 15,1±0,1;
- умеренно токсичный.
1.2-этандиол относят к третьей группе опасности, поэтому предельно допустимые концентрации в атмосфере по ГОСТу могут быть не более 5 миллиграмм/м³.
Применение
Этиленгликоль нашел свое призвание во многих отраслях. Незаменимым веществом является и в автомобилестроении. Его уникальные свойства позволяют создать высококачественные жидкости.
Может регенерировать исходное карбонильное соединение в присутствии воды и кислоты:
- Как компонент противоводокристаллизационной жидкости «И».

- В качестве криопротектора.
- Для поглощения воды, предотвращения образования гидрата метана, который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путем осушения и удаления солей.
- Этиленгликоль является исходным сырьем для производства взрывчатого вещества нитрогликоля.
1,3-диоксоланы могут быть получены при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана. Такие соединения устойчивы к действию нуклеофилов и оснований.
В автомобилях
Благодаря своей дешевизне этиленгликоль нашел широкое применение в технике.
Он может быть использован:
- как компонент тормозных жидкостей и автомобильных антифризов;
- как теплоноситель с содержанием не более 50 % в системах отопления;
- в качестве теплоносителя в виде раствора в автомобилях и системах жидкостного охлаждения компьютеров;
- в производстве полиуретанов, целлофана и ряда других полимеров;
- как растворитель красящих веществ;
- в качестве высокотемпературного растворителя.

- для защиты карбонильной группы путем получения 1,3-диоксолана.
Наиболее известное его направление — компонент автомобильных антифризов. Эта отрасль составляет 60 % его потребления. Такие смеси могут не замерзать при низких температурах, а также коррозийно устойчивы.
В других отраслях
Кроме того 1,2-диоксиэтан является незаменим и в других отраслях промышленности.
1.2-этандиол также применяется:
- при производстве конденсаторов;
- при производстве 1,4-диоксана, пропиленгликоля;
- как теплоноситель в системах чиллер-фанкойл;
- в качестве компонента крема для обуви;
- в составе для мытья стекол вместе с изопропиловым спиртом;
- при криоконсервировании биологических объектов в качестве криопротектора;
- при производстве полиэтилентерефталата, пластика.
И хотя 1,2-диоксиэтан применяют в других отраслях, их процент применения довольно мал.
Вред для человека
Однако 1. 2-этандиол имеет и свои минусы. Неряшливое или неаккуратное его использование может привести к трагическим последствиям.
2-этандиол имеет и свои минусы. Неряшливое или неаккуратное его использование может привести к трагическим последствиям.
Класс опасности вещества
Класс опасности этиленгликоля — третья группа, то есть его контакт с окружающей средой должен быть как можно меньше. Если же 1.2-этандиол попадает в организм человека, в нем могут развиться необратимые негативные явления. При однократном употреблении внутрь 100 и более миллилитров наступает летальный исход.
Пары данного вещества же менее токсичны, однако систематическое вдыхание может привести к гибели. Если человек отравляется гликолем, ему следует принять препарат, который содержит 4-метилпиразол.
Симптомы отравления
В воспалительный процесс вовлекаются все системы органов. Скрытый период отравления этиленгликолем обычно равен 12 часам, но сроки могут изменяться в зависимости от количества употребленного спирта.
Симптомы отравления:
- Первый период проявляется всего несколько часов, но не более 12.
 Характеризуется легким опьянением. Появляется незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В редких случаях беспокоит тошнота, периодическая рвота и боли в животе. От отравленного человека исходит сладковатый запах.
Характеризуется легким опьянением. Появляется незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В редких случаях беспокоит тошнота, периодическая рвота и боли в животе. От отравленного человека исходит сладковатый запах. - Через 12 часов после отравления возникает головокружение и головные боли, жажда и тошнота. Появляется рвота, сильнейшие боли в желудке, боль в пояснице и мышцах.
- Немного позже появляются признаки поражения нервной системы: возбуждение и потеря сознания, многочисленные судороги, повышается температура тела. Отравление этиленгликолем проявляется нарушением работы сердца и сосудов: увеличивается частота биения, снижается артериальное давление.
- Нарушается работа дыхательной системы: постепенно появляется одышка, поверхностное дыхание и отек легких. Тяжелые больные теряют сознание.
- Приблизительно на пятые сутки развивается нарушение в работе печени и почек. Из-за почечной недостаточности возможен летальный исход в течение одной недели.

- Если произошло острое отравление, то наступает смерть из-за паралича дыхательного центра и отека легких.
Легкое отравление возможно при вдыхании паров 1.2-этандиола. Симптомами являются легкая тошнота, слабость.
Меры предосторожности при работе с этиленгликолем
Этиленгликоль является горючем веществом. Температурные пределы воспламенения паров в воздухе начинаются от 112 и заканчиваются 124 °С. Пределы воспламенения паров в воздухе от нижнего до верхнего — 3,8‒6,4 % от объема.
Летальная доза при однократном пероральном употреблении — 100‒300 мл этиленгликоля. Имеет относительно низкую летучесть при нормальной температуре. Опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. П ри отравлении следует принять препараты, содержащие этанол или 4-метилпиразол.
Видео о получении вещества
В следующем видео расскажут о получении гликоля.
youtube.com/embed/VR2PxixGCf0″/>
Формула этиленгликоля в химии
Определение и формула этиленгликоля
ОПРЕДЕЛЕНИЕЭтиленгликоль (этан-1,2-диол ) – сложное кислородсодержащее органическое соединение, двухатомный спирт.
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
- В реакции с обменивают одну или несколько гидроксильных групп на атомы галогена:
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида. Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
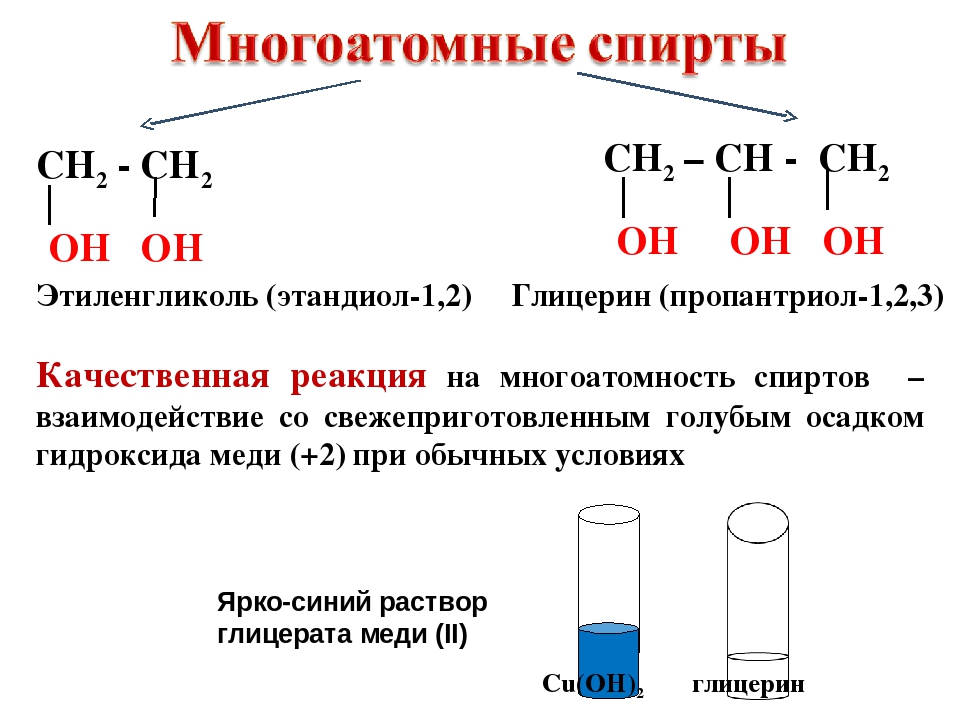
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
Применение
Этиленгликоль в основном используется в составе антифризов , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) .
Примеры решения задач
ПРИМЕР 1| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение | Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля:
Из стехиометрии следует, что г |
| Ответ | г |
| Понравился сайт? Расскажи друзьям! | |||
Этиленгликоль.
 Физические свойства — презентация онлайн
Физические свойства — презентация онлайн1. Этиленгликоль
ЭТИЛЕНГЛИКОЛЬРА Б О Т У В Ы П О Л Н И Л И У Ч Е Н И Ц Ы 1 0 К Л А С С А
САФ Р О Н О ВА Д И А Н А И Л АЗ А Р Е Н КО В И К ТО Р И Я .
2. ВВЕДЕНИЕ
• Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол1,2), — двухатомный спирт, простейший представительмногоатомных спиртов.
• Хим. формула: C2H6O2 или C2h5(OH)2
• Структурная формула: HO—Ch3—Ch3—OH
3. Физические свойства
ФИЗИЧЕСКИЕ СВОЙСТВА• Бесцветная вязкая жидкость без запаха, сладковатого вкуса;
• Хорошо растворяется в воде и в этаноле;
• Температура плавления -12,7 °С;
• Температура кипения 197,6 °С;
• Этиленгликоль токсичен при попадании внутрь, действует на
центральную нервную систему и почки;
4. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА5. Химические свойства
ХИМИЧЕСКИЕ СВОЙСТВА6. получение
ПОЛУЧЕНИЕ• В промышленности этиленгликоль получают путём гидратации оксида этилена при 10
атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или
ортофосфорной кислоты, достигая 90 % выхода.
 Побочными продуктами при этом
Побочными продуктами при этомявляются диэтиленгликоль, триэтиленгликоль и незначительное количество высших
полимергомологов этиленгликоля.
7. История открытий и производства
ИСТОРИЯ ОТКРЫТИЙ ИПРОИЗВОДСТВА
• Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата
этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида.
Он не находил широкого применения до Первой мировой войны, когда в Германии его стали
получать из дихлорэтана для использования в качестве замены глицерина при производстве
взрывчатых веществ. Первое крупномасштабное производство начато с возведением завода в
1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon
Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми
производителями динамита.
8. Применение
ПРИМЕНЕНИЕ• Благодаря своей дешевизне
этиленгликоль нашёл широкое
применение в технике.

• Как компонент автомобильных
антифризов и тормозных жидкостей,
что составляет 60 % его потребления.
Смесь 60 % этиленгликоля и 40 % воды
замерзает при −49 °С.
• В качестве теплоносителя в виде
раствора в автомобилях, в системах
жидкостного охлаждения компьютеров;
• В производстве целлофана,
полиуретанов и ряда других полимеров.
Это второе основное применение;
• Как растворитель красящих веществ;
• В органическом синтезе: в качестве
высокотемпературного растворителя.
• Этиленгликоль также применяется:
• при производстве конденсаторов
• при производстве 1,4-диоксана
• как теплоноситель в системах чиллер-фанкойл (Водоохлаждающая машина аппарат для охлаждения жидкости)
• в качестве компонента крема для обуви (1—2 %)
• в составе для мытья стёкол вместе с изопропиловым спиртом
10. Меры безопасности
МЕРЫ БЕЗОПАСНОСТИ• Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C.
 Температура
Температурасамовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний
— 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4
% (по объему).
• Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса
опасности.
• Летальная доза при однократном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл
на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары
обладают не столь высокой токсичностью и представляют опасность лишь при хроническом
вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об
опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем
являются этанол и 4-метилпиразол.
Одноатомные и многоатомные спирты
Тест :спирты
Вариант 2.
Классифицируйте спирт
CH2 = CH – CH2– OH
+а) непредельный, первичный, одноатомный
б) предельный, вторичный, одноатомный
в) предельный, вторичный, двухатомный
г) непредельный, первичный, двухатомный
В состав молекулы спирта входит функциональная группа
+а) — OH в) — NH2
б) — COOH г) — CHO
3. Вещество CH3 – CH – CH – CH3 называется:
| |
OH OH
а) бутандиол – 1,3 +в) бутандиол – 2,3
б) 3- метилпропанол -2,3 г) 1,2 – диметилэтандиол – 1,2
4. Веществу с названием 3 – метилбутанол– 2
соответствует структурная формула:
а) CH3 – CH – CH2ОН в) CH3 – CH2 – CH – CH2ОН
| |
CH3 CH3
+ б) CH3 г) CH3 – CH2 – CH2 – CH2ОН
\
CH – CH – CH3
/ |
CH3 OH
5. Изомером вещества CH3 – CH – CH2OH является:
Изомером вещества CH3 – CH – CH2OH является:
|
CH3
а) CH2 = CH – CH2 – CH2OH
+б) CH3 – (CH2)2 – CH2OH
в) CH3 – CH – CH – OH г) CH3 – CH – CH2 – CH2OH
| | |
CH3 CH3 CH3
6Уберите «лишнее» вещество
а) CH3OH
б) C2H5OH
в ) C3H7OH
+г) CH3COH
7 Не бывает спирта:
а) непредельного
б) ароматического
в ) вторичного
+ г) четвертичного
8Спирт, структурная формула которого CH3-CH2-CH- CH2-OH
׀
CH3
называется:
а) 2-метилпропанол б) пентанол-1
+в) 2-метилбутанол-1 г) метилбутанол-1
К многоатомным спиртам не относится:
а) глицерин
б) этиленгликоль
=в) пропанол-2
г) бутандиол-2,3
10 Изомером пентанола – 1 не является
А) 3-метилбутанол-1 б) 2-метилбутанол-2
в) 2,2-диметилпропанол-1 + г) 4-метилпентпнол-1
11 Метанол реагирует с
+а) Na
б) CH3OH
в) KOH
г ) FeCl3
Этандиол – 1,2 в отличие от этанола реагирует с
а) HCl
+б ) Cu(OH)2
в ) O2
г) Na
13 Этанол нельзя получить из
а) глюкозы
+б) галогеноводорода
в ) этаналя
г)этановой кислоты
14 По реакции этерификации спирт реагирует с
+а) карбоновой кислотой б) альдегидом
в) алкеном г) фенолом
15 Из спирта нельзя получить
а) сложный эфир б) простой эфир
в) алкен +г) галоген
16. Водородные связи устанавливаются между молекулами:
Водородные связи устанавливаются между молекулами:
А) водорода
Б) этана
В) этилена
+ Г) этанола
17. Предельные одноатомные спирты не взаимодействуют:
А) с О2
+ Б) с KOH
В) с HBr
Г) с CuO
18. Глицерин, как и этанол, взаимодействует:
А) с КОН
Б) с Cu(OH)2
В) с бромной водой
+ Г) с Na
19. Метанол образует СН3ОNa при взаимодействии с
А)NaOH
Б)Na2O
+ В)Na
Г)NaCl
20. При взаимодействии пропанола с CuO получается:
+ А) пропаналь
Б) пропан
В) пропен
Г) пропадиен
21. СН3ОН реагирует с
А) HCOH
Б) C6H5OH
В) H2O
+ Г) CH3COOH
22. Этиленгликоль отличается от этанола реакцией с
+А) Cu(OH)2
Б) CH3CH2CH2COOH
В) Na
Г) HBr
23. Спирт и фенол различаются по реакции с
А) Na
Б) O2
В) K
+Г) NaOH
24. По реакции с CuO из спирта получается:
А) фенол
+ Б) альдегид
В) бензол
Г) углеводород
25. Вещество имеет состав C3H8O3, взаимодействует со свежеприготовленным гидроксидом меди (II) с образованием вещества ярко-синего цвета, получается при гидролизе жиров. Вещество называется
+А) прпантриол-1,2,3
Б) пропанол
В) этиленгликоль
Г) пропаналь
26. При нагревании до 140 оС в присутствии H2SO4из метанола получается:
А) метаналь +В) диметиловый эфир
Б) бензол Г) уксусная кислота
27. Непредельные спирты в отличии от предельных вступает в реакцию
+А) присоединения
Б) горения
В) этерификации
Г) дегидратации
28. Получить альдегид из спирта можно реакцией с
+А) CuO
Б) NaOH
В) Na
Г) карбоновой кислотой
29. Пропанол не реагирует с
+А) CH3CHO
Б) O2
В) CH3CООН
Г) HBr
30. Самым ядовитым предельным одноатомным спиртом, вызывающим слепоту или смерть является:
а) пропанол;
б) этанол;
в) этиловый спирт;
+г) метанол.
Этиленгликоль: структура, формула и применение
Имена, структуры и формулы
У этиленгликоля много разных названий, в зависимости от того, насколько химически специфичными вы хотите быть. К ним относятся:
- Этан-1,2-диол , его название по ИЮПАК. IUPAC — это Международный союз теоретической и прикладной химии.
- 1,2-этандиол
- 2-гидроксиэтанол
- Моноэтиленгликоль
Точно так же его структуру можно показать по-разному, опять же, в зависимости от того, какую конкретную часть этого соединения вы пытаетесь показать более четко.Есть двухмерный и трехмерный (метод мяча и клюшки) способ показать его структуру.
Наконец, и теперь неудивительно, что его формула также может быть записана разными способами:
- HOCh3 Ch3 OH
- C2 H6 O2
- (Ch3 OH) 2.
Использует
Этиленгликоль наиболее часто используется в качестве антифриза в системах отопления и охлаждения.Он также используется в качестве антиобледенителя для самолетов и взлетно-посадочных полос аэропортов.
Другие области применения этиленгликоля включают, но не ограничиваются:
- В гидравлических тормозных жидкостях.
- В качестве растворителя (растворяет другое вещество) для лакокрасочной и пластмассовой промышленности.
- Для производства батарей
- Для производства синтетических волокон, таких как дакрон
- Чтобы помочь сделать чернила для принтера и чернила для той шариковой ручки, которую вы недавно использовали.
Этиленгликоль следует отличать от подобных веществ, а именно от пропиленгликоля.Оба могут снизить температуру замерзания жидкости, такой как вода, и поэтому могут использоваться в качестве антифриза и антиобледенителя. Однако между этими двумя веществами есть два важных различия:
- Этиленгликоль требует меньше энергии для перекачки в холодных условиях и лучше передает тепло при температурах ниже 0 градусов по Фаренгейту.
- Пропиленгликоль намного менее токсичен, чем этиленгликоль
Медицинские вопросы
Мы закончим этот урок, отметив токсичность этиленгликоля.Всего пара унций этиленгликоля может убить человека или даже любимую собаку или кошку. Хотя вкус этой жидкости сладкий, воздействие на здоровье животных, в том числе людей, совсем не так.
Этот яд может повредить печень, почки, мозг и легкие. Сначала человеку кажется, что он выпил алкоголь, но рано или поздно его вырвет, он запутается, почувствует тошноту, у него начнется органная недостаточность и он умрет.
К любому подозрению в том, что вы, кто-то еще или ваш питомец только что выпили этиленгликоль, следует отнестись серьезно и незамедлительно обратиться к лицензированному медицинскому работнику.
Краткое содержание урока
Этиленгликоль — это прозрачная, без запаха, вязкая, сладкая на вкус и ядовитая жидкость на спиртовой основе.
Альтернативные названия этиленгликоля включают:
- Этан-1,2-диол , его название по ИЮПАК
- 1,2-этандиол
- 2-гидроксиэтанол
- Моноэтиленгликоль
Его различные формулы включают:
- HOCh3 Ch3 OH
- C2 H6 O2
- (Ch3 OH) 2.
Среди многих других применений:
- Антифриз
- Антиобледенитель
- В качестве растворителя в лакокрасочной и пластмассовой промышленности
- Для производства батарей, чернил для принтеров, чернил для ручек и синтетических волокон
Помните, несмотря на многочисленные полезные применения, этиленгликоль смертельно ядовит при проглатывании!
Химическая формула — более 100 миллионов химических соединений
Формула быстрого приготовления, содержащая более 100 миллионов соединений
Химическая формула химических соединений — одна из основных сведений для исследований и разработок, которые часто доступны только на определенных веб-сайтах, связанных с химическими веществами, когда соединение не пользуется популярностью.Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс создания формулы химических соединений, доступных в Интернете. Формула может быть мгновенно найдена поиском Google, если Google их проиндексирует.
Общее количество переработанных химических соединений превышает 100 миллионов. Мы будем постоянно обновлять дополнительную информацию о формулах редких химических соединений.
Как найти химическую формулу с помощью поиска Google
Найти информацию о формуле с помощью Google довольно просто. Просто введите свой вводимый текст и добавьте «Mol-Instincts» на экране поиска Google.
Например, если вы хотите найти формулу холестерина, просто введите,
Вы можете использовать другой текст вместо химического названия (холестерин), например номер CAS или ключ InChI, или любую другую имеющуюся у вас информацию.
Что есть в наличии
В дополнение к информации о формуле, основная молекулярная информация, такая как молекулярный вес, химический идентификатор и т. Д.g., имя IUPAC, SMILES String, InChI и др., а также двухмерные и трехмерные изображения.
Щелкните следующую ссылку, чтобы перейти на страницу с примером:
Пример страницы
Формула холестерина — C27h56O | Мол-Инстинкт
Информационный веб-проект Mol-Instincts
Механизм генерации формул был разработан как часть платформы Mol-Instincts для обработки десятков миллионов химических соединений одновременно на автоматической основе, которая выполняется на параллельной вычислительной платформе, оснащенной тысячами ядер ЦП.
Механизм теперь применяется для генерации информации о формулах, доступной в Интернете, для миллиардов химических формул, которые будут созданы в течение нескольких лет.
Свойства 1,2-этандиола — SpringerMaterials
- Молекулярная формула: C 2 H 6 O 2
- Система элементов: C-H-O
- CAS-RN: 107-21-1, 37221-95-7, 71767-64-1
- ИнЧИ: InChI = 1S / C2H6O2 / c3-1-2-4 / h4-4H, 1-2h3
- Ключ InChI: LYCAIKOWRPUZTN-UHFFFAOYSA-N
Исследуй это вещество
Свойства, появляющиеся с 1,2-этандиол
Химические свойства + синтез
- Молекулярный вес: 62.0682
- Расчетный журнал P: -1,098
- Вращающиеся облигации: 3
- H Акцепторы: 2
- H Донаторы: 2
- Реакции, в которых в качестве реагента используется это вещество: 5395
- Реакции с использованием этого вещества в качестве продукта: 168
- Журнальные статьи, содержащие это вещество: 1845 г.
- Патенты, содержащие это вещество: 1278
- Другие публикации, содержащие это вещество: 126
- Поставщики: ABCR, Acros, Alfa Aesar, Ark Pharm, Oakwood, Sigma-Aldrich, VWR
Данные из SPRESIweb
Используя институциональную учетную запись для этого веб-сайта, мы не отслеживаем какую-либо личную, производительность, функциональную информацию, а также информацию, связанную с собственными или сторонними лицами.Мы используем только основные файлы cookie, необходимые для его правильной работы. Пожалуйста, прочтите наш политика конфиденциальности а также Заявление о конфиденциальности для Калифорнии для дополнительной информации.
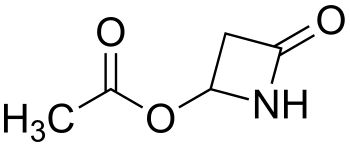
Хорошо1-Фенил-1,2-этандиол 97% | 93-56-1
Ashwini C Mathpati et al.
Journal of biotechnology, 262, 1-10 (2017-09-30)
Кинетическое разрешение rac-1,2-диолов с использованием биокатализатора липазы Burkholderia cepacia (BCL), иммобилизованной на биоразлагаемой бинарной смеси, содержащей гидроксипропилметилцеллюлозу. (HPMC) / поливиниловый спирт (PVA).Техника иммобилизации значительно повысила активность ферментов и имеет отличную возможность вторичной переработки с …
Yanbin Liu et al.
Журнал промышленной микробиологии и биотехнологии, 33 (4), 274-282 (2005-12-02)
Микроорганизм, способный катализировать разделение рацемического фенилоксирана, был изолирован и идентифицирован как Aspergillus niger SQ-6. Хиральный капиллярный электрофорез был успешно применен для разделения фенилоксирана и фенилэтандиола.Эпоксидгидролаза (EH), участвующая в этом разрешении …
Yao Nie et al.
Органическая и биомолекулярная химия, 9 (11), 4070-4078 (2011-04-21)
Применение биокатализа для синтеза хиральных молекул является одной из самых экологически чистых технологий для замены химических маршрутов из-за экологической благоприятные условия реакции и беспрецедентная хемо-, регио- и стереоселективность. Нас интересовали …
Lingyun Rui et al.
Прикладная микробиология и микробиология окружающей среды, 71 (7), 3995-4003 (2005-07-08)
Перестановка ДНК и мутагенез насыщения в положениях F108, L190, I219, D235 и C248 были использованы для создания вариантов эпоксидгидролазы. Agrobacterium radiobacter AD1 (EchA) с повышенной энантиоселективностью и активностью в отношении оксида стирола и повышенной активностью в отношении 1,2-эпоксигексана…
Пабло Табоада и др.
Langmuir: журнал ACS поверхностей и коллоидов, 21 (12), 5263-5271 (2005-06-01)
Три триблок-сополимера этиленоксида и фенилглицидилового эфира, тип E (m) G (n) E (m), где G = OCh3CH (Ch3OC6H5) и E = OCh3Ch3, были синтезированы и охарактеризованы методами гель-проникающей хроматографии, матричной лазерной десорбционно-ионизационной времяпролетной масс-спектрометрии и ЯМР-спектроскопии. Их ассоциативные свойства …
Этиленгликоль — обзор
11.4.3 Механизм коррозии
Чистый этиленгликоль имеет очень плохую электропроводность и почти изолирует. В лаборатории было измерено, что удельное сопротивление чистого этиленгликоля примерно в 40 раз выше, чем у воды типа II по ASTM [27]. Следовательно, удельное сопротивление раствора этиленгликоля будет уменьшаться с увеличением содержания воды. Более того, разбавление водой способствует гидролизу гидроксильных групп этиленгликоля, что также приводит к увеличению проводимости.Измеренное в лаборатории удельное сопротивление 33 об.% Раствора этиленгликоля составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). . Следовательно, высокое сопротивление раствора играет важную роль в коррозии.
В растворе этиленгликоля коррозионные повреждения магния локализованы. Язвенная коррозия хорошо видна на поверхности [27], а окружающая область, где она не подверглась коррозии, относительно блестящая.Яма представляет собой активный анод, а окружающая его блестящая область представляет собой катод, защищенный от коррозии в результате точечной коррозии. На рисунке 11.5 схематично показана локальная питтинговая коррозия и соответствующая эквивалентная схема для магния в растворе этиленгликоля. В эквивалентной схеме C d — это емкость не корродированной области образца магния, R pt и C pt — сопротивление и емкость в нижней части корродирующего ( точечной коррозии), R ps — сопротивление раствора в яме, а R s — сопротивление раствора между электродом сравнения и образцом магния.Следовательно, общее сопротивление поляризации R p может быть выражено как: R p = R ps + R pt . Из-за высокого удельного сопротивления раствора отношение R ps к R pt очень велико ( R ps >> R pt ), и, следовательно, R p ≈ R пс .
11.5. Модель питтинга магния в растворе этиленгликоля и соответствующая схема замещения.
Локальное коррозионное повреждение означает, что скорость точечной коррозии ограничена сопротивлением раствора в яме, и, таким образом, удельное сопротивление раствора может значительно повлиять на коррозионную стойкость или сопротивление поляризации магния в растворе этиленгликоля. Вывод был подтвержден измеренной линейной зависимостью между сопротивлением поляризации и удельным сопротивлением раствора [27]; поскольку сопротивление раствора увеличивается с увеличением концентрации этиленгликоля, сопротивление поляризации также увеличивается.Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис. 11.2).
В загрязненном растворе этиленгликоля сопротивление раствора снижается с увеличением концентрации каждого загрязняющего вещества NaCl, Na 2 SO 4 или NaHCO 3 . Уменьшение поляризационного сопротивления магния можно объяснить повышенным общим содержанием ионов в растворе. При низком содержании загрязняющих веществ проводимость раствора пропорциональна концентрации электролитов.Снижение стойкости к растворам особенно заметно при увеличении концентрации NaCl. Это объясняет наиболее пагубное влияние NaCl на коррозионные характеристики магния в загрязненном растворе этиленгликоля. Снижение стойкости раствора, вызванное загрязнителями, также может объяснить незначительное повышение скорости коррозии магния в этиленгликоле при добавлении Mg (OH) 2 и Mg (NO 3 ) 2 (рис. 11.3).
Помимо стойкости к раствору, наиболее фундаментальным объяснением коррозионного поведения магния в этиленгликоле может служить граница раздела магний / этиленгликоль.Как и большинство других органических веществ, этиленгликоль может адсорбироваться на поверхности электрода. Емкость C d является хорошим показателем адсорбции этиленгликоля на поверхности магния. Было измерено [27], что емкость уменьшается с увеличением концентрации этиленгликоля. Уменьшение емкости интерфейса может быть вызвано тем, что вода с высокой диэлектрической проницаемостью на границе раздела заменяется более длинными молекулами диэлектрика. Молекула этиленгликоля больше и менее полярна, чем вода.Его адсорбция на поверхности магния, безусловно, может привести к снижению C d . Когда концентрация этиленгликоля увеличивается, больше этиленгликоля будет адсорбироваться на поверхности, что приведет к снижению C d . Другими словами, поверхность магния более полно покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, который более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис.11.2).
В загрязненном растворе NaCl, Na 2 SO 4 и NaHCO 3 меньше по размеру, чем этиленгликоль. Увеличение емкости должно быть связано с заменой этиленгликоля на поверхности магния загрязняющими веществами. SO 4 2- и HCO 3 — могут адсорбироваться на поверхности магния сильнее (легче), чем Cl —. Дополнительный адсорбированный этиленгликоль можно заменить на Na 2 SO 4 или NaHCO 3 , и в результате этого обмена получается более высокая поверхностная емкость, чем от NaCl при той же весовой / объемной концентрации этих загрязняющих веществ.Тем не менее хорошо известно, что хлориды намного более агрессивны, чем сульфаты и карбонаты. Достаточно всего нескольких адсорбированных ионов хлорида, чтобы значительно ускорить растворение магния на адсорбированных участках. Таким образом, скорость коррозии магния в хлоридсодержащем растворе этиленгликоля выше, чем в растворе этиленгликоля, содержащем Na 2 SO 4 или NaHCO 3 .
Более сильная адсорбция Na 2 SO 4 или NaHCO 3 , чем хлорид, означает, что если ионы Na 2 SO 4 или NaHCO 3 добавляются в хлоридсодержащий раствор этиленгликоля, адсорбированные ионы Cl — на поверхности магния будут заменены сульфатом или карбонатом.Поскольку сульфат или карбонат гораздо менее агрессивны для магния, чем хлорид, замена адсорбированных хлоридов сульфатами или карбонатами фактически пассивирует активные центры на поверхности магния. Следовательно, растворение магния замедляется. Следовательно, в хлоридсодержащем растворе Na 2 SO 4 или NaHCO 3 будут играть двойную роль. С одной стороны, ингибирующее действие Na 2 SO 4 или NaHCO 3 приводит к пассивации.С другой стороны, добавление Na 2 SO 4 или NaHCO 3 в хлоридсодержащий раствор этиленгликоля снижает стойкость раствора, что приводит к снижению коррозионной стойкости. После того, как большая часть адсорбированных хлорид-ионов на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может уменьшить только R s раствора. Следовательно, скорость коррозии магния сначала уменьшается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 .
Спирты и эфиры | Химия
ЦЕЛИ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Описать структуру и свойства спиртов
- Описать структуру и свойства эфиров
- Назовите и начертите структуру спиртов и простых эфиров
Спирты
Включение атома кислорода в углеродные и водородсодержащие молекулы приводит к новым функциональным группам и новым семействам соединений.Когда атом кислорода присоединен одинарными связями, молекула представляет собой спирт или эфир.
Спирты представляют собой производные углеводородов, в которых группа –ОН заменяет атом водорода. Хотя все спирты имеют одну или несколько гидроксильных (–OH) функциональных групп, они не ведут себя как основания, такие как NaOH и KOH. NaOH и KOH — ионные соединения, содержащие ионы OH — . Спирты — ковалентные молекулы; группа –ОН в молекуле спирта присоединена к атому углерода ковалентной связью.
Этанол, CH 3 CH 2 OH, также называемый этиловым спиртом, является особенно важным спиртом для использования человеком. Этанол — это спирт, производимый некоторыми видами дрожжей, который содержится в вине, пиве и дистиллированных напитках. Его уже давно готовят люди, использующие метаболические усилия дрожжей для ферментации различных сахаров:
Большие количества этанола синтезируются в результате реакции присоединения воды к этилену с использованием кислоты в качестве катализатора:
Могут быть получены спирты, содержащие две или более гидроксильных группы.Примеры включают 1,2-этандиол (этиленгликоль, используемый в антифризах) и 1,2,3-пропантриол (глицерин, используемый в качестве растворителя для косметики и лекарств):
Именование спиртов
Название спирта происходит от углеводорода, из которого он был получен. Окончательный — e в названии углеводорода заменяется на -ol , а атом углерода, с которым связана группа –OH, обозначается числом перед названием.
Пример 1
Именование спиртов
Рассмотрим следующий пример.Как его назвать?
Решение
Углеродная цепь содержит пять атомов углерода. Если бы гидроксильная группа отсутствовала, мы бы назвали эту молекулу пентаном. Чтобы решить тот факт, что гидроксильная группа присутствует, мы меняем окончание названия на –ol . В этом случае, поскольку –ОН присоединен к углероду 2 в цепи, мы назвали бы эту молекулу 2-пентанолом.
Проверьте свои знания
Назовите следующую молекулу:
Ответ: 2-метил-2-пентанол
эфиров
Простые эфиры — это соединения, содержащие функциональную группу –O–.У эфиров нет обозначенного суффикса, как у других типов молекул, которые мы до сих пор называли. В системе ИЮПАК атом кислорода и меньшая углеродная ветвь называются алкоксизаместителем, а остальная часть молекулы — основной цепью, как в алканах. Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который будет называться «метокси». Более крупной углеродной ветвью будет этан, образующий молекулу метоксиэтана. Многие эфиры упоминаются под общими именами вместо системных имен IUPAC.Для общепринятых названий две ветви, связанные с атомом кислорода, называются отдельно, за ними следует –ether. Обычное название соединения, показанного в примере 2, — этилметиловый эфир:
.Пример 2
Именование эфиров
Укажите IUPAC и общее имя для показанного здесь эфира:
Решение
ИЮПАК: молекула состоит из этоксигруппы, присоединенной к цепи этана, поэтому название ИЮПАК будет этоксиэтан.
Общее: Обе группы, присоединенные к атому кислорода, являются этильными группами, поэтому общее название — диэтиловый эфир.
Проверьте свои знания
Укажите IUPAC и общее название для показанного эфира:
Ответ: ИЮПАК: 2-метоксипропан; обычный: изопропилметиловый эфир
Эфиры могут быть получены из спиртов путем отщепления одной молекулы воды от двух молекул спирта. Например, когда этанол обрабатывают ограниченным количеством серной кислоты и нагревают до 140 ° C, образуются диэтиловый эфир и вода:
В общей формуле простых эфиров R- O -R углеводородные группы (R) могут быть одинаковыми или разными.Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется. Впервые он был использован в 1846 году в качестве анестетика, но теперь его место в значительной степени заняли более качественные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются в основном в качестве растворителей для камедей, жиров, восков и смол. Третичный -бутилметиловый эфир, C 4 H 9 OCH 3 Используется (сокращенно МТБЭ — выделенные курсивом части названий не учитываются при ранжировании групп в алфавитном порядке — поэтому бутил стоит перед метилом в общем названии). как добавка к бензину.МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности увеличивать содержание кислорода в бензине.
Хотите попрактиковаться в присвоении имен эфирам? Этот краткий видеообзор обобщает номенклатуру эфиров.
Углеводы и диабет
Углеводы — это большие биомолекулы, состоящие из углерода, водорода и кислорода. Диетические формы углеводов — это продукты, богатые этими типами молекул, например паста, хлеб и конфеты.Название «углевод» происходит от формулы молекул, которые можно описать общей формулой C m (H 2 O) n , которая показывает, что они в некотором смысле являются «углеродом и водой» или «Гидраты углерода». Во многих случаях m и n имеют одинаковое значение, но могут быть разными. Меньшие углеводы обычно называют «сахарами», биохимический термин для этой группы молекул — «сахарид» от греческого слова, обозначающего сахар (рис. 1).В зависимости от количества соединенных вместе сахарных единиц они могут быть классифицированы как моносахариды (одна сахарная единица), дисахариды (две сахарные единицы), олигосахариды (несколько сахаров) или полисахариды (полимерная версия сахаров — полимеры были описаны в раздел, посвященный переработке пластмасс ранее в этой главе). Научные названия сахаров можно узнать по суффиксу –ose в конце названия (например, фруктовый сахар — это моносахарид, называемый «фруктоза», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы. , соединены вместе).Сахара содержат некоторые из функциональных групп, которые мы обсуждали: Обратите внимание на спиртовые группы, присутствующие в структурах, и то, как моносахаридные звенья связаны с образованием дисахарида путем образования простого эфира.
Рис. 2. На рисунках показаны молекулярные структуры фруктозы, пятиуглеродного моносахарида, и лактозы, дисахарида, состоящего из двух изомерных шестиуглеродных сахаров.
Организмы используют углеводы для множества функций. Углеводы могут накапливать энергию, такую как полисахариды гликоген у животных или крахмал у растений.Они также обеспечивают структурную поддержку, такую как полисахаридная целлюлоза в растениях и модифицированный полисахарид хитин в грибах и животных. Сахара рибоза и дезоксирибоза являются компонентами скелета РНК и ДНК соответственно. Другие сахара играют ключевую роль в функции иммунной системы, в распознавании клеток и во многих других биологических функциях.
Диабет — это группа метаболических заболеваний, при которых у человека наблюдается высокая концентрация сахара в крови (рис. 2).Диабет может быть вызван недостаточной выработкой инсулина поджелудочной железой или клетками организма, которые не реагируют должным образом на вырабатываемый инсулин. У здорового человека инсулин вырабатывается, когда он необходим, и выполняет функцию транспортировки глюкозы из крови в клетки, где ее можно использовать для получения энергии. Долгосрочные осложнения диабета могут включать потерю зрения, болезни сердца и почечную недостаточность.
По оценкам, в 2013 году примерно 3,3% населения мира (~ 380 миллионов человек) страдали диабетом, что приводило к более чем миллиону смертей ежегодно.Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Рисунок 2. Диабет — это заболевание, характеризующееся высокой концентрацией глюкозы в крови. Лечение диабета включает изменение образа жизни, контроль уровня сахара в крови и иногда инъекции инсулина. (кредит: «Blausen Medical Communications» / Википедия)
Ключевые концепции и резюме
Многие органические соединения, не являющиеся углеводородами, можно рассматривать как производные углеводородов.Производное углеводорода может быть образовано заменой одного или нескольких атомов водорода углеводорода функциональной группой, которая содержит, по меньшей мере, один атом элемента, отличного от углерода или водорода. Свойства углеводородных производных во многом определяются функциональной группой. Группа –OH является функциональной группой спирта. Группа –R – O – R– представляет собой функциональную группу простого эфира.
Химия: упражнения в конце главы
- Почему соединения гексан, гексанол и гексен имеют такие похожие названия?
- Напишите сокращенные формулы и укажите названия по ИЮПАК для следующих соединений:
- спирт этиловый (в напитках)
- спирт метиловый (используется в качестве растворителя, например, в шеллаке)
- этиленгликоль (антифриз)
- изопропиловый спирт, CH 3 CH (OH) CH 3 , используется в медицинском спирте)
- глицерин
- Дайте полное название ИЮПАК для каждого из следующих соединений:
- Дайте полное название ИЮПАК и общее название для каждого из следующих соединений:
- Запишите конденсированные структуры обоих изомеров формулой C 2 H 6 O.Обозначьте функциональную группу каждого изомера.
- Запишите конденсированные структуры всех изомеров формулой C 2 H 6 O 2 . Обозначьте функциональную группу (или группы) каждого изомера.
- Нарисуйте сокращенные формулы для каждого из следующих соединений:
- дипропиловый эфир
- 2,2-диметил-3-гексанол
- 2-этоксибутан
- МТБЭ, метил трет -бутиловый эфир, CH 3 OC (CH 3 ) 3 , используется в качестве источника кислорода в кислородсодержащих бензинах.МТБЭ получают путем реакции 2-метилпропена с метанолом.
- Используя структуры Льюиса, напишите химическое уравнение, представляющее реакцию.
- Какой объем метанола плотностью 0,7915 г / мл требуется для производства ровно 1000 кг МТБЭ при 100% выходе?
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сжатых формул и одно с использованием структур Льюиса.
- пропанол превращается в дипропиловый эфир Пропен
- обрабатывают водой в разбавленной кислоте.
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сжатых формул и одно с использованием структур Льюиса.
- 2-бутен обрабатывают водой в разбавленной кислоте
- этанол обезвоживают с получением этена
Избранные ответы
2. (а) этиловый спирт, этанол: CH 3 CH 2 OH
(б) метиловый спирт, метанол: CH 3 OH
(c) этиленгликоль, этандиол: HOCH 2 CH 2 OH
(d) изопропиловый спирт, 2-пропанол: CH 3 CH (OH) CH 3
(e) глицерин, 1,2,3-тригидроксипропан: HOCH 2 CH (OH) CH 2 OH
4.{2} \ text {L} \ end {array} [/ latex]
10. (a) [латекс] {\ text {CH}} _ {3} \ text {CH} = {\ text {CHCH}} _ {3} + {\ text {H}} _ {2} \ текст {O} \ rightarrow {\ text {CH}} _ {3} {\ text {CH}} _ {2} {\ text {CH (OH) CH}} _ {3} [/ latex]
(b) [латекс] {\ text {CH}} _ {3} {\ text {CH}} _ {2} \ text {OH} \ rightarrow {\ text {CH}} _ {2} = {\ текст {CH}} _ {2} + {\ text {H}} _ {2} \ text {O} [/ latex]
Глоссарий
спирт
органическое соединение с гидроксильной группой (–OH), связанной с атомом углерода
эфир
органическое соединение с атомом кислорода, связанным с двумя атомами углерода
Глава 2 — Спирты, фенолы, тиолы, эфиры — CHE 120 — Введение в органическую химию — Учебник
2.5 Реакции спиртов
Цели обучения
- Приведите два основных типа реакций спиртов.
- Опишите результат окисления первичного спирта.
- Опишите результат окисления вторичного спирта.
Химические реакции в спиртах протекают в основном в функциональной группе, но в некоторых из них участвуют атомы водорода, присоединенные к ОН-несущему атому углерода или соседнему атому углерода. Из трех основных видов алкогольных реакций, которые представлены на Рисунке 2.4 «Реакции спиртов» здесь рассматриваются две — дегидратация и окисление. Третий тип реакции — этерификация — описан в главе 4 «Карбоновые кислоты, сложные эфиры», разделе 4.8 «Получение сложных эфиров».
Рисунок 2.4 Реакции спиртов
Рассмотрены окисление и дегидратация спиртов.
Обезвоживание
Как показано на Рисунке 2.4 «Реакции спиртов», спирт подвергается дегидратации в присутствии катализатора с образованием алкена и воды.В результате реакции удаляется группа ОН у атома углерода спирта и атом водорода у соседнего атома углерода в одной и той же молекуле:
При надлежащих условиях обезвоживание может происходить между двумя молекулами спирта. Вся группа ОН одной молекулы и только атом водорода группы ОН второй молекулы удаляются. Две этильные группы, присоединенные к атому кислорода, образуют молекулу эфира.
(Эфиры обсуждаются в разделе 2.4 «Реакции, в которых образуются спирты». Таким образом, в зависимости от условий можно получить либо алкены, либо простые эфиры путем дегидратации спиртов.
Примечание
Реакции дегидратации и гидратации протекают непрерывно в клеточном метаболизме, при этом ферменты служат катализаторами и при температуре около 37 ° C. (Для получения дополнительной информации о реакциях гидратации см. Главу 1 «Обзор органической химии / углеводороды», раздел 1.14 «Химические свойства алкенов».) На пути Эмбдена – Мейерхофа происходит следующая реакция.(Для получения дополнительной информации о метаболических реакциях см. Главу 11 «Метаболические пути и производство энергии».)
Хотя участвующие соединения являются сложными, реакция одинакова: удаление воды из исходного материала. Идея состоит в том, что если вы знаете химию определенной функциональной группы, вы знаете химию сотен различных соединений.
Окисление
Первичные и вторичные спирты легко окисляются. Ранее мы видели, как метанол и этанол окисляются ферментами печени с образованием альдегидов.Поскольку различные окислители могут вызывать окисление, мы можем указать окислитель без указания конкретного, написав уравнение с символом [O] над стрелкой. Например, мы запишем окисление этанола — первичного спирта — с образованием ацетальдегида — альдегида — следующим образом:
Мы увидим (в главе 3 «Альдегиды, кетоны», раздел 3.1 «Альдегиды и кетоны: структура и названия»), что альдегиды окисляются даже легче, чем спирты, и дают карбоновые кислоты.
Вторичные спирты окислены до кетонов . Окисление изопропилового спирта дихроматом калия (K 2 Cr 2 O 7 ) дает ацетон, простейший кетон:
В отличие от альдегидов, кетоны относительно устойчивы к дальнейшему окислению (Глава 3 «Альдегиды, кетоны» Раздел 3.1 «Альдегиды и кетоны: структура и названия»), поэтому не требуется специальных мер для их выделения по мере их образования.
Обратите внимание, что при окислении как первичных (RCH 2 OH), так и вторичных (R 2 CHOH) спиртов из молекулы спирта удаляются два атома водорода, один из группы OH, а другой из атома углерода, который несет Группа ОН.
Примечание
Эти реакции также можно проводить в лаборатории с химическими окислителями. Одним из таких окислителей является дихромат калия. Сбалансированное уравнение (показывающее только частицы, участвующие в реакции) в этом случае выглядит следующим образом:
Окисление спирта важно для живых организмов. Реакции окисления, контролируемые ферментами, обеспечивают энергетические клетки, необходимые для полезной работы. Один из этапов метаболизма углеводов включает окисление вторичной спиртовой группы в изоазимной кислоте до кетонной группы:
Обратите внимание, что общий тип реакции такой же, как и при превращении изопропилового спирта в ацетон.(Для получения дополнительной информации о метаболических реакциях см. Главу 11 «Метаболические пути и производство энергии».)
Третичные спирты (R 3 COH) устойчивы к окислению, поскольку атом углерода, несущий группу ОН, не имеет присоединенного атома водорода, а вместо этого связан с другими атомами углерода. Описанные нами реакции окисления включают образование двойной связи углерод-кислород. Таким образом, атом углерода, несущий группу ОН, должен иметь возможность высвободить один из присоединенных к нему атомов для образования двойной связи.Связь углерод-водород легко разрывается в окислительных условиях, а связи углерод-углерод — нет. Следовательно, третичные спирты не окисляются легко.
Пример 4
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 ОН
Решение
Первый шаг — определить класс каждого алкоголя как первичный, вторичный или третичный.
Этот спирт имеет группу ОН на атоме углерода, который присоединен только к одному другому атому углерода , так что это первичный спирт. При окислении сначала образуется альдегид, а при дальнейшем окислении образуется карбоновая кислота.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к трем другим атомам углерода, так что это третичный спирт. Никакой реакции не происходит.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к двум другим атомам углерода, так что это вторичный спирт; окисление дает кетон.
Упражнение по развитию навыков
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
Упражнения по обзору концепции
В реакции соединение W с молекулярной формулой C 4 H 10 O превращается в соединение X с формулой C 4 H 8 O.Является ли W окисленным, восстановленным, обезвоженным или ничего из этого? Объяснять.
В реакции 2 моль соединения Y с молекулярной формулой C 4 H 10 O превращается в 1 моль соединения Z с формулой C 8 H 18 O. Окисляется, восстанавливается, или ни то, ни другое? Объяснять.
ответов
ни; вода удалена
Основные выводы
- Спирты можно дегидратировать с образованием либо алкенов (более высокая температура, избыток кислоты), либо простых эфиров (более низкая температура, избыток спирта).
- Первичные спирты окисляются с образованием альдегидов.
- Вторичные спирты окисляются с образованием кетонов.
- Третичные спирты плохо окисляются.
Упражнения
1. Назовите три основных типа химических реакций спиртов.
2. Почему третичные спирты не окисляются? Может ли третичный спирт подвергаться обезвоживанию?
3.
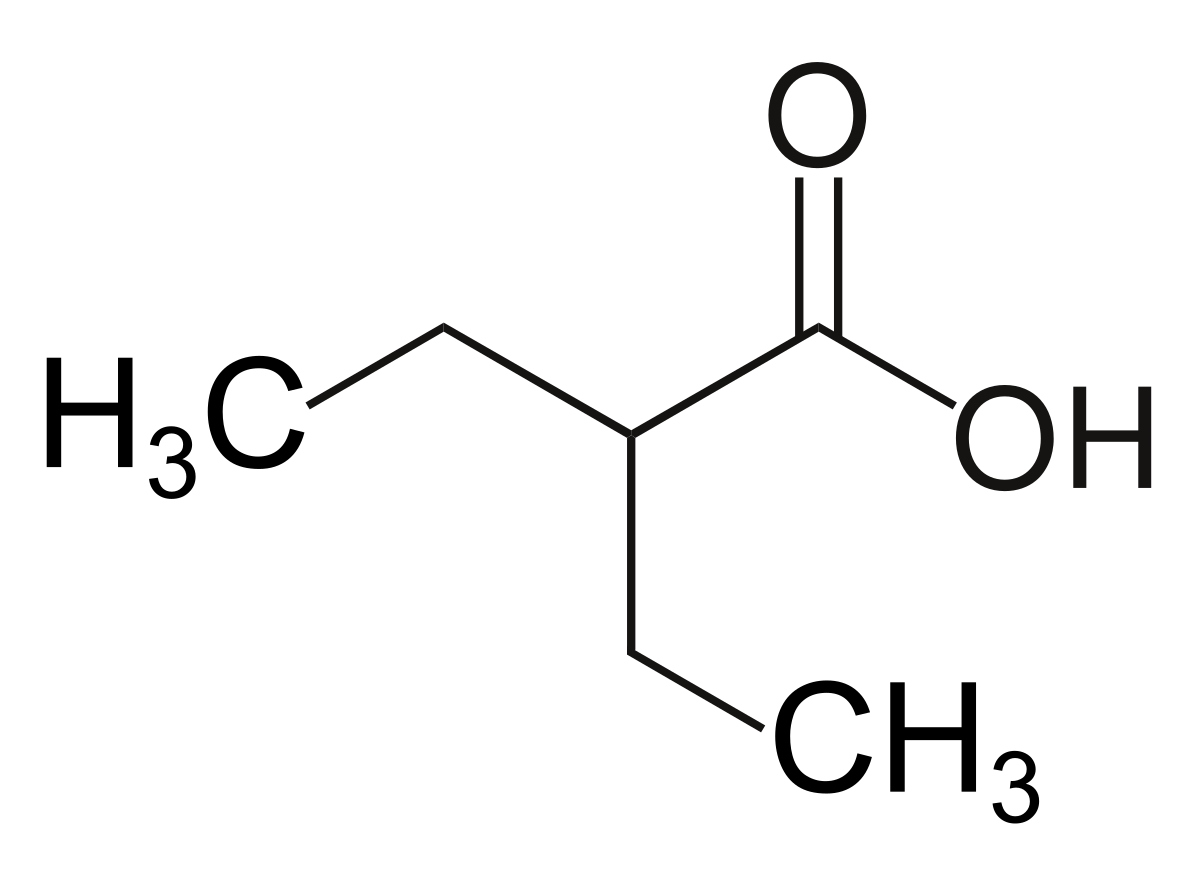
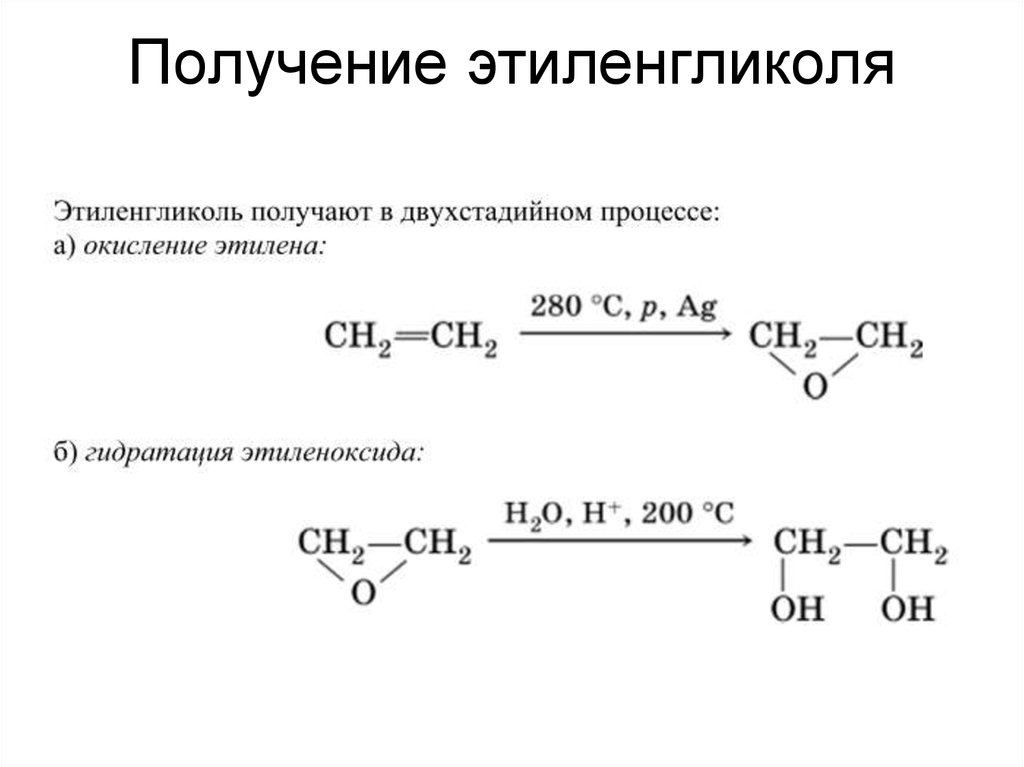
 Характеризуется легким опьянением. Появляется незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В редких случаях беспокоит тошнота, периодическая рвота и боли в животе. От отравленного человека исходит сладковатый запах.
Характеризуется легким опьянением. Появляется незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В редких случаях беспокоит тошнота, периодическая рвота и боли в животе. От отравленного человека исходит сладковатый запах.