Сдача экзамена пдд теория по новым правилам: Билеты ПДД 2022/2021 Экзамен ПДД ABM/CD(СД) от ГИБДД
Новые правила сдачи на водительские права утвердят в начале 2021 года — Общество
МОСКВА, 27 ноября. /ТАСС/. Новый административный регламент по проведению экзаменов на право управления транспортными средствами может быть подписан в начале следующего года. Об этом ТАСС сообщил источник в правоохранительных органах.
«Новый административный регламент может быть подписан уже в начале следующего года. Пока проект документа обсуждается, и, возможно, в него будут внесены изменения», — сказал собеседник агентства.
Ранее сообщалось, что проект нового регламента должен был вступить в октябре этого года, но из-за пандемии коронавируса сроки перенесены на 1 апреля 2021 года. Документ устанавливает содержание, сроки и последовательность административных процедур практического экзамена.
Площадка только для мотоциклистов
Новые правила исключают проведение практического экзамена на площадке для водителей легковых, грузовых автомобилей, автобусов и составов транспортных средств.
Согласно проекту, при проведении экзамена в машине может находиться представитель автошколы и другие кандидаты в водители.
«Проведение проверки имеющихся у кандидата в водители навыков только в условиях реальной дорожной обстановки в конечном итоге повлекут изменения в подходе автошкол при проведении практического обучения вождению транспортными средствами», — отмечается в пояснительной записке проекта нового регламента. Сообщается, что это исключит «натаскивание» на определенные виды упражнений на закрытой площадке, а также позволит избежать переориентирования подготовки кандидатов к управлению транспортными средствами в реальных дорожных условиях вне зоны «заученных» учебных маршрутов.
Также сокращение практических экзаменов позволит уменьшить время на получение водительских прав.
Новые упражнения
Экзамен дополнится новыми упражнениями, а несколько заданий изменят.
«Так, экзамен на право управления транспортным средством подкатегории «В1″ (квадроциклы и трициклы) дополнен проверкой у кандидата в водители навыков торможения транспортного средства и остановки при движении на различных скоростях, включая экстренное торможение, а также прямолинейного движения задним ходом», — говорится в пояснительной записке.
Пересмотр ошибок
Изменения претерпит также система оценки навыков кандидата в водители в условиях дорожного движения и ошибки с учетом степени их влияния на безопасность.
«Например, ошибки «не пристегнул ремень безопасности» и «использовал во время движения телефон» будут являться основанием для прекращения проведения практического экзамена», — говорится в документе.
В новом документе сокращается общее количество нарушений, которые ведут к автоматическому провалу на экзамене. Сейчас их 17, а в документе это количество предполагается снизить до 15.
Аннулирование
При подаче нового заявления кандидатом в водители категории «В», ранее уже подавшим обращение в другое экзаменационное подразделение, услуга по предыдущему обращению будет прекращена. Также вводятся административные процедуры по аннулированию результатов экзаменов и аннулированию водительского удостоверения.
«Такое аннулирование может быть осуществлено только по основаниям, предусмотренным Правилами проведения экзаменов, а само аннулирование будет осуществляться путем внесения сведений об аннулировании водительского удостоверения в информационные системы Госавтоинспекции, в том числе в автоматизированном режиме», — отмечается в документе.
Теоретический экзамен не изменится
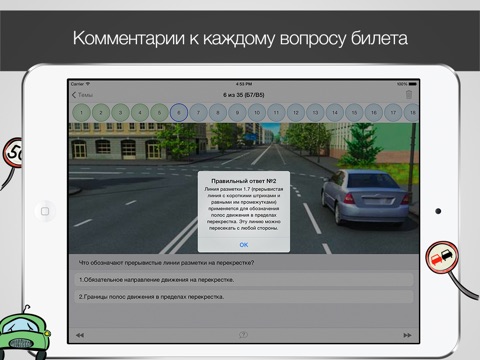
Ранее сообщалось, что Госавтоинспекция планирует увеличить число вопросов в теоретической части экзамена на получение водительских прав, а также изменить порядок приема испытания, то есть каждому вопросу планировалось присвоить определенное количество баллов, но, согласно проекту регламента, пока этого не будет. «Все экзаменационные вопросы объединяются в четыре группы, состоящие из тематических блоков. В каждом тематическом блоке содержится по пять вопросов. Билет формируется из четырех тематических блоков, каждый из которых выбирается случайным образом из соответствующей группы. Перестановка вопросов между тематическими блоками не допускается. В экзаменационном билете содержится 20 вопросов. На каждый вопрос приводится от двух до пяти вариантов ответов, один из которых правильный», — говорится в документе.
«Все экзаменационные вопросы объединяются в четыре группы, состоящие из тематических блоков. В каждом тематическом блоке содержится по пять вопросов. Билет формируется из четырех тематических блоков, каждый из которых выбирается случайным образом из соответствующей группы. Перестановка вопросов между тематическими блоками не допускается. В экзаменационном билете содержится 20 вопросов. На каждый вопрос приводится от двух до пяти вариантов ответов, один из которых правильный», — говорится в документе.
Зачем в МВД хотят изменить билеты по «теории» при сдаче экзамена на права? | ГИБДД | Авто
Вопрос об изменении теоретической части билетов при сдаче экзамена на права рассматривают в МВД РФ. В ведомстве намерены добиться от водителей осознанного понимания правил дорожного движения для безопасного управления транспортными средствами. Об этом со ссылкой на ведомство сообщает ТАСС.
Почему планируют ввести изменения?
 В ведомстве подчеркнули, что в первую очередь речь идет о ДТП с участием водителей, чей стаж за рулем — менее двух лет.
В ведомстве подчеркнули, что в первую очередь речь идет о ДТП с участием водителей, чей стаж за рулем — менее двух лет.«В настоящее время Главным управлением по обеспечению безопасности дорожного движения МВД РФ прорабатывается вопрос изменения подходов к формированию экзаменационных билетов при проведении теоретического экзамена на право управления транспортными средствами», — сообщают в ведомстве.
Какие знания хотят получить в МВД от водителей?
Чтобы водитель грамотно мог оценить обстановку на дороге и быстро отреагировать на угрозу аварии, ему нужно научиться осознанно применять на практике полученные в автошколе знания, считают в МВД.
«Одной из основных целей изменения экзаменационных билетов является смещение акцента от „заучивания“ конкретных требований правил дорожного движения к осознанному пониманию безопасных действий при управлении транспортным средством в различных дорожных ситуациях с учетом психологических аспектов поведения участников дорожного движения», — пояснили в ведомстве.
Как изменят теоретический экзамен на права?
Насколько изменятся вопросы в экзаменационных билетах, в ведомстве не уточнили. Планируется, что в дальнейшем МВД России представит соответствующие нормативно-правовые акты на общественное обсуждение.
Как изменилась практическая часть экзамена на права?
С 1 апреля 2021 года практический экзамен на получение водительских прав теперь состоит только из одной части — поездки по городу (сдачу навыков вождения на закрытой площадке отменили). Экзаменатор может менять маршрут по ходу движения, а в машине, помимо сотрудника ГИБДД, может находиться представитель автошколы и другие кандидаты в водители. Подробнее об изменениях читайте здесь.
Источник информации
https://tass.ru/obschestvo/12127427?utm_source=yxnews&utm_medium=desktop
Правила сдачи экзамена в ГИБДД с 1 апреля 2021г
С 1 апреля 2021 года изменяются правила сдачи практического экзамена в ГИБДД. Для кандидатов в водители автобусов, легковых и грузовых автомобилей исключается этап «экзамен на площадке».
Таким образом, вместо привычных трех этапов экзамена на права — «теория», «площадка» и «город», вводится двухэтапная схема в виде теоретического и практического экзаменов
Практический экзамен, сдаваемый на площадке, теперь переносится на реальную дорогу. С 1 апреля будущие водители легковых и грузовых машин, а также автобусов, будут демонстрировать свои навыки не на закрытой территории, а в условиях реального дорожного движения.
Непосредственно, сам список упражнений для сдачи экзамена, практически не изменился. Но среди них были, в том числе, и те упражнения, которые выполнялись только на автодроме:
Это параллельная парковка, разворот в ограниченном пространстве, заезд в бокс задним ходом, начало движения на подъеме, и другие (включая работу с прицепом). Интересно то, что упражнения «Повороты на 90 градусов» и «Новая змейка» в этих списках не значатся.
По новым правилам перечисленные экзаменационные упражнения могут сдаваться как на автодроме, так и на дорогах с малой интенсивностью движения. Итоговое решение о том, как и в каком месте проводить экзамен, будут принимать инспектирующие службы.
Итоговое решение о том, как и в каком месте проводить экзамен, будут принимать инспектирующие службы.
Для кандидатов в водители мотоциклов и мопедов проведение практического экзамена остается прежним. Экзамены на категории A, M, A1 и B1 будут приниматься традиционно на автодроме, в т.ч. автоматизированном, и (или) на закрытой площадке.
С 1 апреля изменяется перечень ошибок и нарушений, за которые начисляются штрафные баллы на экзамене по вождению. Штрафные баллы приведены в Приложении 8 к Административному регламенту МВД по проведению экзаменов на право управления ТС и выдаче ВУ.
С этой же даты допускается присутствие стороннего наблюдателя в салоне автомобиля во время проведения экзамена. Наблюдателем может быть как представитель автошколы, так и кандидат, ждущий своей очереди на экзамен.
Также меняются сроки и правила пересдачи экзаменов в случае несдачи теории или практики по вождению.
Если кандидат в водители не смог сдать теорию с первого раза, то пересдать он сможет только через 7 дней, и должен это сделать не позднее, чем через 30 дней со дня проведения предыдущего несданного теоретического экзамена.
Если кандидат в водители 3 раза подряд не сдаст теорию, то следующая попытка возможна не раньше, чем через 1 (один) месяц, и не позже, чем через 3 (три) месяца со дня проведения предыдущего несданного теоретического экзамена.
Успешный результат сдачи теоретического экзамена действителен в течение 6 (шести) месяцев. В течение этого срока необходимо успеть сдать практический экзамен.
Кандидат в водители, не сдавший практический экзамен, сможет его пересдать повторно не ранее чем через 7 и не позднее 60 календарных дней со дня проведения предыдущего несданного практического экзамена.
Кандидат в водители, проваливший практический экзамен трижды и более раз, сможет его пересдать не ранее, чем через 1 (один) месяц и не позднее 3 (трех) месяцев со дня проведения предыдущего несданного практического экзамена.
Теоретический или практический экзамены могут быть пересданы и позднее указанных сроков. Для этого кандидату в водители необходимо подать заявление в подразделение Госавтоинспекции о переносе сроков проведения повторного экзамена.
Все изменения в сдаче экзамена на права (с 1 апреля) — журнал За рулем
Из практической части экзамена исключат этап «площадка», а вот наполнение билетов трогать не стали.
Материалы по теме
МВД завершает разработку регламента сдачи экзамена на водительские права, который вступит в силу 1 апреля этого года. ТАСС рассказывает подробности нового документа со ссылкой на пресс-центр МВД.
Без «площадки»
Этап «площадка» исключен для будущих водителей автобусов, легковых и грузовых автомобилей. Практический экзамен на право управления мотоциклами, мопедами, квадроциклами и трициклами сохраняется в действующем варианте — на закрытых площадках.
При проведении экзамена в машине могут находиться представители автошколы и общественных объединений, а также другие кандидаты в водители. Маршрут кандидату в водители заранее известен не будет, по регламенту его выберет экзаменатор из утвержденного перечня дорог и улиц.
Штрафные баллы
Материалы по теме
Система оценки навыков кандидата изменится с учетом их влияния на безопасность.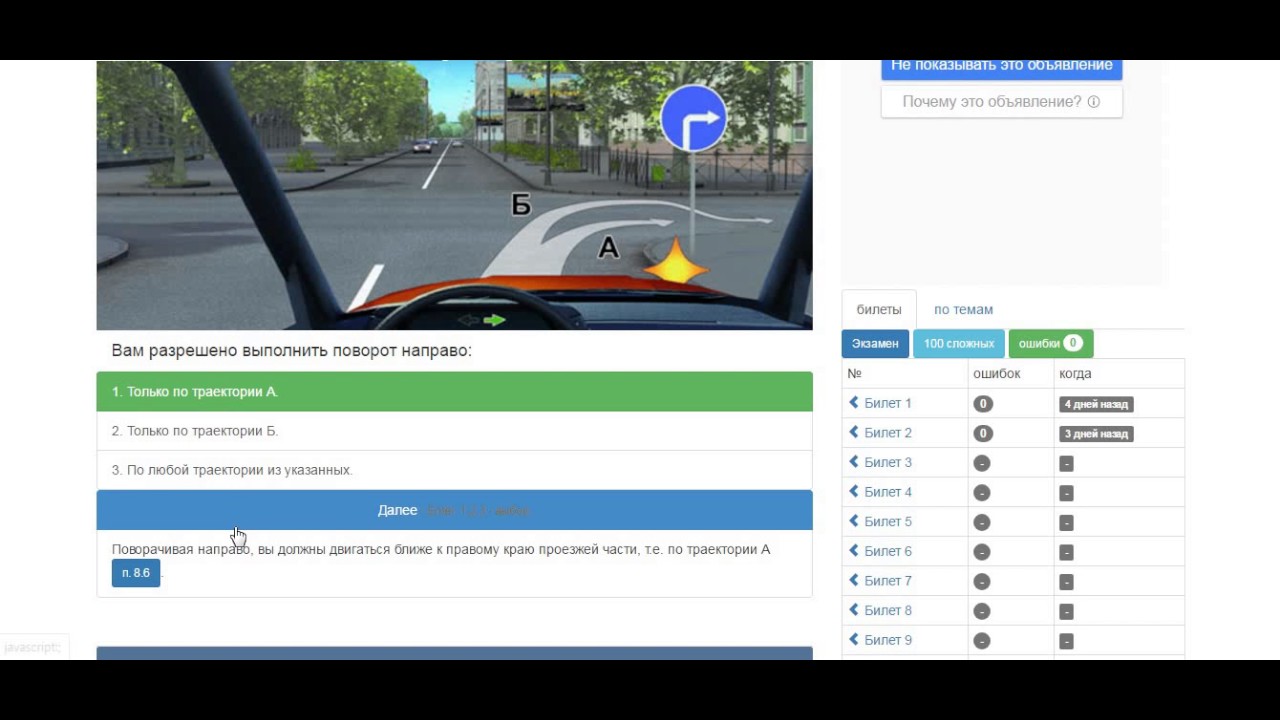 Предусмотрено 19 грубейших ошибок, за совершение любой из которых экзамен сразу прекращается. Это непристегнутый ремень, пользование мобильным телефоном либо иным техническим устройством, позволяющим вести переговоры, непредоставление преимущества другому транспортному средству или пешеходу, обгон, поворот, разворот с нарушением правил и т.д.
Предусмотрено 19 грубейших ошибок, за совершение любой из которых экзамен сразу прекращается. Это непристегнутый ремень, пользование мобильным телефоном либо иным техническим устройством, позволяющим вести переговоры, непредоставление преимущества другому транспортному средству или пешеходу, обгон, поворот, разворот с нарушением правил и т.д.
За нарушения, не входящие в список (всего 41 пункт), будут начисляться штрафные баллы. Если кандидат получит пять штрафных баллов, это будет означать, что экзамен не сдан.
Недопуск к экзамену
Есть 6 оснований для недопуска кандидата в водители к экзамену: лишение прав, предоставление недостоверной информации или поддельных документов, неоплаченная госпошлина, отсутствие лицензии у автошколы, где учился кандидат в водители.
Сдавать на права можно будет с 16 лет. Несовершеннолетние должны будут предоставить письменное согласие одного из законных представителей.
Аннулирование
Результаты экзаменов и водительское удостоверение могут быть аннулированы по основаниям, предусмотренным правилами проведения экзаменов.
Теория не изменится
Теоретическую часть решили не трогать, хотя сначала обсуждали вопрос увеличения количества вопросов в теоретической части экзамена.
В экзаменационном билете по-прежнему останется 20 вопросов, на каждый приведено от двух до пяти вариантов ответа, один из которых правильный. Для ответа на них предоставляется 20 минут. Если кандидат допустил две ошибки в разных тематических блоках вопросов, ему предоставляется возможность в течение 10 минут ответить на 10 вопросов из двух дополнительных тематических блоков.
Фото: Донат Сорокин/ТАСС
Факты о новом табачном правиле FDA
FDA регулирует все табачные изделия, включая (как показано): кальян, электронные сигареты, растворимые вещества, бездымный табак, сигареты, все сигары, табак для самостоятельного скручивания, трубочный табак и будущие табачные изделия, которые соответствуют определению закона табачное изделие.
Español
The U.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США недавно доработало правило, которое распространяет свои регулирующие полномочия на все табачные изделия, включая электронные сигареты, сигары, кальяны и трубочный табак, в рамках своей цели по улучшению здоровья населения.
«До этого окончательного правила эти продукты можно было продавать без какой-либо проверки их ингредиентов, способа их изготовления и их потенциальных опасностей», — объясняет Митч Зеллер, доктор медицины, директор Центра табачных изделий FDA. «В соответствии с этим новым правилом мы предпринимаем шаги, чтобы защитить американцев от опасностей, связанных с табачными изделиями, гарантировать, что на этих табачных изделиях есть предупреждения о вреде для здоровья, и ограничить продажи несовершеннолетним.”
Остались вопросы по этому правилу? Читайте ответы.
Что делает это новое правило?
Это новое правило основано на наработках, заложенных около семи лет назад. FDA регулирует сигареты, сигаретный табак, самокрутящийся табак и бездымные табачные изделия с июня 2009 года, после того, как Конгресс принял и президент подписал Закон о предотвращении курения в семье и борьбе против табака. Этот закон дал агентству полномочия регулировать производство, распространение и маркетинг табачных изделий.
FDA регулирует сигареты, сигаретный табак, самокрутящийся табак и бездымные табачные изделия с июня 2009 года, после того, как Конгресс принял и президент подписал Закон о предотвращении курения в семье и борьбе против табака. Этот закон дал агентству полномочия регулировать производство, распространение и маркетинг табачных изделий.
Сегодня правило выполняет несколько функций.
Он расширяет регулирующие полномочия FDA на все табачные изделия, включая электронные сигареты, которые также называются электронными сигаретами или электронными системами доставки никотина (ЭСДН), все сигары (в том числе премиум-класса), кальян (также называемый табаком для кальяна), трубочный табак. , никотиновые гели и растворимые вещества, которые ранее не подпадали под юрисдикцию FDA.
Он требует наличия предупреждений о вреде для здоровья на табаке для самокруток, сигаретном табаке и некоторых недавно регулируемых табачных изделиях, а также запрещает бесплатные образцы.Кроме того, в соответствии с правилом производители табачных изделий, которые недавно были подвергнуты регулированию, которых не было на рынке по состоянию на 15 февраля 2007 г. , должны будут продемонстрировать, что изделия соответствуют применимым стандартам общественного здравоохранения, установленным законом. И эти производители должны будут получить разрешение на продажу от FDA.
, должны будут продемонстрировать, что изделия соответствуют применимым стандартам общественного здравоохранения, установленным законом. И эти производители должны будут получить разрешение на продажу от FDA.
Новое правило также ограничивает доступ молодежи к недавно регулируемым табачным изделиям: 1) запрещая продажу продукции лицам моложе 18 лет и требуя подтверждения возраста с помощью удостоверения личности с фотографией; и 2) запрет на продажу табачных изделий в торговых автоматах (кроме заведений, предназначенных только для взрослых).
Наконец, он дает основу для будущих действий FDA в отношении табака.
Почему FDA предприняло это действие?
Цель FDA — защитить американцев от болезней и смерти, связанных с табаком. Употребление табака — серьезная угроза общественному здоровью.
Важно отметить, что правила FDA в отношении этих продуктов не означают, что они безопасны в использовании. Но до этого правила не было федерального закона, запрещающего розничным продавцам продавать электронные сигареты, кальяны или сигары молодежи в возрасте до 18 лет. За последнее десятилетие значительно снизилось употребление традиционных сигарет среди молодежи, но потребление ими других табачных изделий растет. Текущее употребление электронных сигарет среди старшеклассников резко возросло с 1,5 процента в 2011 году до 16 процентов в 2015 году (более чем на 900 процентов), а потребление кальяна значительно выросло, согласно опросу, проведенному при поддержке FDA и Центров по контролю за заболеваниями. и профилактика.
За последнее десятилетие значительно снизилось употребление традиционных сигарет среди молодежи, но потребление ими других табачных изделий растет. Текущее употребление электронных сигарет среди старшеклассников резко возросло с 1,5 процента в 2011 году до 16 процентов в 2015 году (более чем на 900 процентов), а потребление кальяна значительно выросло, согласно опросу, проведенному при поддержке FDA и Центров по контролю за заболеваниями. и профилактика.
Это правило позволяет FDA защищать молодежь, ограничивая ее доступ к табачным изделиям.
Какие характеристики продукта будет рассматривать FDA?
Процесс обзора табачных изделий позволяет FDA оценивать важные факторы, такие как ингредиенты, дизайн продукта и риски для здоровья, а также привлекательность продукции для молодежи и тех, кто ее не употребляет.
Каковы сроки?
FDA ожидает, что производители будут продолжать продавать свою продукцию в течение двух лет, пока они подадут — и еще год, пока FDA рассматривает — новую заявку на табачную продукцию.
FDA издаст приказ о выдаче разрешения на продажу, если это необходимо. В противном случае продукт подвергнется принудительному применению FDA.
Что в итоге?
Правило поможет помешать молодым людям начать использовать эти продукты, поможет потребителям лучше понять риски использования этих продуктов, запретит ложные и вводящие в заблуждение заявления о продуктах и предотвратит продажу новых табачных продуктов, если производитель не продемонстрирует, что эти продукты соответствуют требованиям соответствующий стандарт общественного здравоохранения.
Но разве электронные сигареты не безопаснее обычных? А как быть с нагрузкой на малый бизнес?
FDA признает, что некоторые табачные изделия могут быть менее вредными, чем другие. Но необходимы дополнительные доказательства. Агентство изучает этот вопрос в отношении регулирования табака.
FDA считает, что эта новая технология имеет как потенциальные преимущества, так и риски. Если некоторые продукты, такие как электронные сигареты, обладают меньшей токсичностью по сравнению с обычными сигаретами; побудить курильщиков полностью отказаться от курения; и / или не используются широко молодежью, они могут способствовать снижению заболеваемости и смертности. Но если какой-либо продукт побуждает молодых людей пристраститься к никотину, снижает интерес человека к отказу от сигарет и / или ведет к долгосрочному употреблению с другими табачными изделиями, воздействие на общественное здоровье может быть негативным.
Но если какой-либо продукт побуждает молодых людей пристраститься к никотину, снижает интерес человека к отказу от сигарет и / или ведет к долгосрочному употреблению с другими табачными изделиями, воздействие на общественное здоровье может быть негативным.
FDA поощряет производителей к изучению инновационных продуктов, которые позволят максимизировать потенциальные выгоды и минимизировать риски. Последнее правило позволяет FDA дополнительно оценивать и оценивать влияние этих продуктов на здоровье как пользователей, так и непользователей. И это позволяет FDA регулировать продукты на основе самых последних научных знаний.
FDA учло всех производителей, включая малые предприятия, при окончательной доработке этого правила. Вот почему агентство дает мелким производителям табачных изделий дополнительное время для соблюдения определенных положений.
Итак, какие продукты могут помочь мне бросить курить?
FDA одобрило ряд продуктов в качестве средств помощи при отказе от курения, которые помогают снизить вашу зависимость от никотина. Продукция включает никотиновую жевательную резинку, никотиновые пластыри на коже, никотиновые леденцы, никотиновые ингаляционные продукты для перорального применения и никотиновый назальный спрей, а также не содержащие никотин лекарства, называемые варениклином и бупропионом.
Вы также можете получить бесплатную помощь в отказе от курения, позвонив по телефону 1-800-QUIT-NOW или посетив сайт www.smokefree.gov.
к началу
Таблетка для лечения коронавирусаMerck получила одобрение F.D.A. Панель
В ходе клинических испытаний было обнаружено, что молнупиравир снижает на 30 процентов риск госпитализации или смерти при назначении невакцинированным добровольцам из группы высокого риска в течение пяти дней после того, как у них начали проявляться симптомы.Он оказался значительно менее эффективным, чем таблетки Pfizer, которые, как было установлено, снижают этот риск на 89 процентов. Было обнаружено, что лечение моноклональными антителами снижает риск госпитализации или смерти как минимум на 70 процентов.
Пандемия коронавируса: основные сведения
Карточка 1 из 4
Всемирная кампания вакцинации. Спустя год после начала глобального развертывания вакцины разрыв в показателях вакцинации между странами с высоким и низким уровнем доходов стал больше, чем когда-либо.Анализ Times показывает, что проблемы с инфраструктурой и уровень готовности населения пройти вакцинацию могут создавать более серьезные препятствия, чем предложение.
Предполагая, что F.D.A. разрешает использование молнупиравира, поначалу запасы, вероятно, будут ограничены.
Кроме того, сжатые сроки получения таблеток могут стать проблемой. Предполагается, что лечение Merck начнется в течение пяти дней с момента появления симптомов и будет приниматься в виде 40 таблеток в течение пяти дней.
Пациентам, скорее всего, потребуется получить положительный результат теста на коронавирус и обратиться к врачу, который выпишет рецепт на упаковку таблеток, которую можно будет забрать в аптеке.Но на получение результатов теста ПЦР часто уходят дни, а в некоторых частях страны трудно найти тесты, дающие результаты в течение 15 минут. Кроме того, у многих людей нет обычных врачей, к которым можно было бы обращаться за рецептами.
Администрация Байдена заказала достаточно курсов лечения Merck по цене около 700 долларов на человека для 3,1 миллиона человек. Ожидается, что Merck поставит эти таблетки до февраля. Напротив, ожидается, что до конца февраля Pfizer поставит своих таблеток ровно настолько, чтобы охватить 300 000 человек в Соединенных Штатах.
Один вопрос, который нависает над лечением, — сколько подходящих американцев откажутся от приема новых таблеток. В опросе Morning Consult, опубликованном на этой неделе, около половины непривитых взрослых — основная группа, которая, как ожидается, будет нуждаться в таблетках, — заявили, что не будут принимать противовирусные таблетки, одобренные FDA, если они заболеют Covid.
Ряд членов комитета подняли вопросы о безопасности таблеток. Лечение работает путем вставки ошибок в гены вируса. Некоторые ученые говорят, что существует теоретический риск того, что он также может вызвать мутации в клетках, потенциально вызывая репродуктивный вред или долгосрочный риск рака.
«Общий риск мутагенности у людей считается низким», — заявила на встрече доктор Эйми Ходованек, старший медицинский сотрудник FDA, имея в виду способность препарата вызывать мутации в ДНК людей, принимающих его. .
Почему одобрение FDA не гарантирует безопасность лекарств
Неуместное доверие: почему одобрение FDA не гарантирует безопасность лекарств Перейти к основному содержаниюThe U.Предполагается, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США должно защищать американцев от вредных наркотиков. Но на самом деле одобрение FDA не гарантирует безопасности. Критики говорят, что Big Pharma финансирует проверки новых лекарств Управлением по контролю за продуктами и лекарствами, что создает конфликт интересов. Агентство слишком сосредоточено на утверждении лекарств, чтобы успокоить Big Pharma, и ему не хватает надлежащих полномочий и финансирования для защиты населения.
Кому я звоню?Позвонив по этому номеру, вы сможете связаться с представителем Drugwatch.Мы направим вас к одному из наших надежных юридических партнеров для бесплатного рассмотрения дела.
Надежные юридические партнерыDrugwatch поддерживают миссию организации по защите людей от опасных лекарств и медицинских устройств. Для получения дополнительной информации посетите страницу наших партнеров.
(855) 993-0976 Подписывайтесь на нашу новостную рассылкуПодпишитесь на нашу рассылку, чтобы быть в курсе опасных лекарств и устройств, узнавать новости о судебных процессах и урегулировании, узнавать об отзыве FDA и многое другое.
Ваш веб-браузер больше не поддерживается Microsoft. Обновите свой браузер для большей безопасности, скорости и совместимости.
Если вы хотите поговорить с представителем Drugwatch, позвоните по телефону 888-645-1617
История федерального регулирования: 1902 — настоящее время
Основное законодательство в отношении лекарственных средств и медицинских изделий:
Девятнадцатый и начало двадцатого века
Закон о биопрепаратах 1902 года
Закон о пищевых продуктах и лекарствах 1906 года
Закон Харрисона о наркотиках 1914 года
Закон о пищевых продуктах, лекарствах и косметических средствах 1938 года
Поправка Дарем-Хамфри, 1951 год
Поправки Миллера о пестицидах 1954 года
Поправки о пищевых добавках от 1958 г.
Поправки о красителях от 1960 г.
Поправки Кефовера-Харриса от 1962 г.
Поправки к лекарствам для животных от 1968 г.
Поправки к медицинским устройствам от 1976 г. Закон Ваксмана-Хэтча 1984 г.
Закон об экспорте лекарств 1986 г.
Закон о маркировке пищевых продуктов и образовании (NLEA) 1990 г.
Закон о безопасных медицинских устройствах (SMDA) 1990 г. Закон об образовании (DSHEA) 1994 г.
Закон о модернизации FDA 1997 г.
Расширение FDA за рубежом в 2008 г.
Девятнадцатый и начало двадцатого века
На рубеже ХХ века аптека была молодой и незрелой наукой.Большинство лекарств по-прежнему создавалось вручную в местной аптеке. Часто не существовало технологий для оценки и обеспечения единообразия лекарств. Действительно, главной задачей фармации девятнадцатого и начала двадцатого века было определить, что такое лекарство, и создать стандарты состава, чистоты и силы действия. Новаторские усилия в этом направлении начались в 1820 году с создания Фармакопеи США ( USP ). Частное, добровольное предприятие врачей, фармацевтов и фармацевтических колледжей, USP представляет собой формуляр составов и перечисленных химических соединений, сырых лекарств, жирных масел и других веществ, которые обычно хранятся у фармацевта (затем называемого фармацевтом или аптекарем). ).Позже в USP перечислены тесты для определения чистоты. Ведущие фармацевты регулярно пересматривают USP по мере открытия и создания новых и лучших лекарств, композиций и тестов. Медики, заинтересованные в развитии своего ремесла и достоинстве своей профессии, образовали государственные медицинские общества и фармацевтические ассоциации, Американскую медицинскую ассоциацию (AMA, 1848 г.) и Американскую фармацевтическую ассоциацию (APA, 1852 г.). Крупные общества и ассоциации часто публиковали журналы, сотрудничали с медицинскими школами и иногда содержали комитеты по фальсификации лекарств для проверки образцов лекарств и публикации информации.Фармацевты составили Национальный формуляр , впервые опубликованный APA в 1888 году. Формуляр функционирует с 1896 года, чтобы предоставить стандарты для лекарств, исключенных из USP , и служить в качестве испытательной площадки для лекарств, в конечном итоге переданных в USP. . (О более ранней истории USP и National Formulary см. Sonnedecker 1970.)
Но до двадцатого века не существовало прямого федерального регулирования лекарств или других потребительских товаров.В 1848 году Конгресс запретил ввоз фальсифицированных лекарств, но закон быстро утратил силу, поскольку наркологи обычно были неподготовленными политическими спекулянтами (Young 1970, 151). В годы реконструкции было сформировано химическое бюро Министерства сельского хозяйства США, предшественника FDA. Бюро, состоящее всего из нескольких человек, лишь требовало таможенного досмотра импортных продуктов питания и, в меньшей степени, лекарств. В 1883 году в бюро появился праведный и буйный руководитель в лице Харви Вашингтон Вили, который выступал за федеральные законы.
Закон о биопрепаратах 1902 года
Обычным примером в истории федерального контроля над наркотиками было шокирующее событие, которое высвободило новые правительственные полномочия. В 1901 году зараженные противооспенные вакцины и антитоксины от дифтерии привели к вспышкам столбняка и смерти нескольких детей. Вакцины, кровь и продукты крови, экстракты живых клеток и другие лекарства относятся к категории биологических препаратов. Закон о биопрепаратах 1902 года требовал, чтобы федеральное правительство выдавало предварительное разрешение на каждое биологическое лекарство, а также на процесс и установку, производящую такие лекарства.Никогда прежде в Соединенных Штатах не существовало такого предмаркетного контроля. То же предпродажное регулирование было предписано в отношении биологических препаратов для животных в Законе о вирусах, сыворотке и токсинах 1913 года (Miller 2000).
Закон о чистых пищевых продуктах и лекарствах 1906 г.
В 1906 году в книге Аптона Синклера « Джунгли » описаны грязные условия на мясокомбинате. В самом шокирующем инциденте рабочий падает в канистру сала, его без разбору измельчают и отправляют на продажу. Примерно в то же время в мире документальной литературы глава химического бюро Харви Уайли завербовал группу молодых людей в «Отряд отравы».Добровольцы отряда принимали формальдегид, борную кислоту и другие пищевые красители и консерванты в концентрированном виде. В конце концов их пищеварительная система показала пагубные последствия. Драматические трюки Уайли снискали ему народное прозвище «Крестоносец» и вдохновили на популярные песни о его патриотично-самоотравляющих учениках. Комбинация Poison Squad и The Jungle побудила Конгресс принять Закон о чистых продуктах питания и лекарствах в 1906 году.
Закон 1906 года признал U.S. Pharmacopoeia и Национальный формуляр в качестве официальных стандартов силы, качества и чистоты лекарств и тестов для таких определений. Таким образом, закон 1906 года определил фальсифицированное лекарство как лекарство, которое было указано в USP , но не соответствовало спецификациям USP (если только отклонения от USP не были четко обозначены). Практики, однако, присвоили USP «официальный» статус задолго до того, как спецификации USP были утверждены законом.Кроме того, несколько штатов уже ссылались на USP при определении фальсификации. Таким образом, федеральный закон санкционировал то, что уже широко, хотя и не повсеместно, практиковалось.
Закон 1906 года включал положения против «неправильного брендинга. Наркотик считался недействительным, если он содержал алкоголь, морфин, опиум, кокаин или любой из нескольких других потенциально опасных или вызывающих привыкание наркотиков, и , если на его этикетке не было указано количество или пропорция таких наркотиков.(Закон относился только к маркировке, а не к рекламе.)
Для потребителей главный результат закона 1906 г. заключался не в ограничении выбора, а в предоставлении дополнительной информации. Кроме того, ученые из Химического бюро выполнили полезную и важную работу по разработке анализов и тестов, которые помогают идентифицировать и очищать лекарства и унифицировать производство. Поскольку федералы не могли использовать принудительную власть на премаркете, Химическое бюро и промышленность доверяли друг другу и сотрудничали, чтобы улучшить производство лекарств.
Однако оговорка о недопустимости «ложной и вводящей в заблуждение» маркировки изначально использовалась агрессивно. В соответствии с этим пунктом федеральные правоохранительные органы преследовали многих производителей, продававших «лекарства» от головной боли, облысения, рака и других болезней. Судебное преследование обычно приводило к конфискации и мелким штрафам. Когда правительство привлекло к уголовной ответственности «Доктора Дж. «Мягкое комбинированное лечение рака Джонсона», — сопротивлялся производитель, д-р Джонсон, передав дело в Верховный суд. Суд согласился с Джонсоном, постановив, что любые терапевтические претензии являются предметом мнения.Отсюда следует, что не существует авторитетного медицинского мнения, которое принудительно отменяет другие, и, следовательно, никакие обвинения не могут быть выдвинуты против терапевтических заявлений, если продавцы действительно не предназначались для мошенничества. Судья Оливер Уэнделл Холмс подтвердил, что FDA должно «регулировать торговлю продуктами питания и лекарствами с точки зрения очевидного факта, чтобы продукты питания были такими, какими они себя называли [,]. . . [скорее], чем искажать использование своей конституционной власти для установления критериев в регионах, где мнения сильно расходятся »(цитируется по Temin 1980, 33).Стремясь преодолеть ограничения, установленные Верховным судом, Конгресс принял поправку Шерли в 1912 году, но эта поправка запрещала только «ложные и мошеннические» претензии, то есть претензии, которые продавец знал как ложные, поэтому он не смог доставить искомую — для расширения мощности. Более того, закон не расширил полномочия полиции в отношении «ложных и мошеннических» заявлений о рекламе.
После постановления Верховного суда и поправки Шерли функция FDA была закреплена за отслеживанием идентификации наркотиков.Тем не менее, события этого раннего периода создали прецедент для активности федерального правительства в медицине.
Между тем, в 1927 году регулирующие функции Химического бюро были реорганизованы в Управление по контролю за продуктами питания, лекарствами и инсектицидами, которое в 1930 году изменило свое название на Управление по контролю за продуктами и лекарствами.
Закон Харрисона о наркотиках 1914 года
Закон Харрисона о наркотиках 1914 года установил налог на производство, продажу и использование опиума и требовал рецептов на продукты, превышающие допустимый лимит наркотиков.Этот закон также потребовал усиленного учета врачей и фармацевтов, продающих наркотики. Первоначально закон был принят для обеспечения упорядоченного сбыта наркотиков, но позже был истолкован как запрещающий поставку наркотиков даже наркоманам по рецепту врача. По закону Харрисона тысячи врачей были заключены в тюрьму за прописывание наркотиков.
Закон о пищевых продуктах, лекарствах и косметических средствах 1938 года
При новой администрации Франклина Д. Рузвельта FDA немедленно начало требовать дополнительных регулирующих полномочий, но в отношении лекарств ничего не произошло до следующего шокирующего эпизода.Хорошо зарекомендовавшая себя фармацевтическая компания Massengill выпустила новый сульфамидный препарат (антибактериальное средство) под названием Elixir Sulfanilamide. Сам препарат прошел множество проверок качества и безопасности, но при производстве жидкой формы компания не провела испытания растворителя. Обладая приятным зеленым оттенком, этот растворитель, диэтиленгликоль, более известный сегодня как антифриз, оказывал смертельное воздействие на почки. В результате 107 человек, в основном дети, умерли до того, как продукт был быстро отозван.
История «Эликсира» часто рассказывается, чтобы сетовать на скудность федерального контроля.FDA могло привлечь к ответственности Massengill только за неправильный брендинг: продукт Elixir Sulfanilamide не содержал алкоголя и, следовательно, не подходил под определение эликсира. Ничего нельзя было поделать со смертью Эликсира, гласит обычное причитание, потому что Массенгилл не предъявлял мошеннических заявлений в отношении продукта. Сообщается, что трагедия продемонстрировала, что свободные рынки причиняют безрассудный ущерб и что общественная безопасность требует принятия дополнительных законов.
Этот рассказ, однако, полностью упускает из виду роль деликтного закона в предоставлении компенсации жертвам и в содействии сдерживанию.Во время эпизода с «Эликсиром» общее право действительно предусматривало средства правовой защиты от вреда, причиненного неправильным брендом или фальсифицированными лекарствами, и Massengill был успешно привлечен к уголовной ответственности за грубую халатность (Krauss 1996). Химик, ответственный за создание эликсира сульфаниламида, покончил жизнь самоубийством.
Через несколько месяцев после трагедии Конгресс принял Закон о пищевых продуктах, лекарствах и косметических средствах 1938 года. Конституция не дает федеральному правительству никаких полномочий по регулированию наркотиков. Как это часто бывает, клин в федеральный контроль заключался в праве федерального правительства регулировать торговлю между штатами.Таким образом, законы, регулирующие наркотики, были составлены таким образом, чтобы их можно было применять только к лекарствам, используемым или производимым более чем в одном штате. Учитывая широкое — иногда абсурдно широкое — толкование, которое суды придавали статье о торговле между штатами, на практике закон регулирует все наркотики, несмотря на первоначальные намерения создателей.
Акт 1938 г. включал несколько положений, которые оказались значительными клиньями для будущего расширения власти. Самым значительным изменением было требование, чтобы производители подали заявку на новый лекарственный препарат (NDA) в FDA.В приложении будет указан состав лекарственного средства, будут представлены результаты испытаний на безопасность, а также описан способ производства и контроля качества лекарственного средства. Если компания представит NDA, оно будет автоматически одобрено через шестьдесят дней, если FDA не примет никаких мер. Таким образом, положением по умолчанию было одобрение; бремя доказывания отклонения от позиции по умолчанию легло на FDA, и в результате затраты FDA для общественности оставались низкими.
В некоторой степени Закон 1938 г. продолжил выполнение требований Закона 1906 г. о предоставлении информации.Например, классификация «неправильный бренд» была расширена и теперь включает любой препарат, на этикетке которого не указаны и количественно не указаны точные ингредиенты, перечислены эффекты и возможные побочные эффекты, а также даны указания и предостерегающая информация, которую мог бы понять даже наименее образованный человек. понимать.
Другие положения ограничили выбор и уменьшили количество информации для потребителей. Доказательства мошенничества больше не требовались для прекращения «ложных» заявлений о наркотиках. Ложь, конечно же, означала бы «расценивается FDA как ложная».Таким образом был возведен пьедестал авторитетных знаний относительно правды и лжи для всех пользователей во всех ситуациях.
Неясное положение Закона о пищевых продуктах, лекарствах и косметических средствах и ряда последующих регулирующих решений FDA привело к созданию нового класса лекарств, отпускаемых только по рецепту. Первоначальные законы о маркировке были призваны предоставить потребителям больше информации и, таким образом, улучшить их способность принимать правильные решения. Намерение Конгресса при принятии закона состояло в том, чтобы способствовать достижению цели создания информированных потребителей.Действительно, комитет Палаты представителей, представляющий законопроект, недвусмысленно заявил, что «[этот] закон никоим образом не ограничивает доступность лекарств для самолечения. Напротив, оно призвано сделать самолечение более безопасным и эффективным »(цитируется по Temin 1992, 351). Тем не менее, FDA решило, что некоторые лекарства могут быть маркированы как , а не . Таким образом, в некоторых случаях FDA требовало, чтобы лекарства были маркированы таким образом, чтобы потребитель не мог их понять, или же они были маркированы только предупреждением «Осторожно: для использования только по рецепту врача или по его рецепту».В последнем случае продажа без рецепта была незаконной.
Традиционно производитель решал, является ли лекарство отпускаемым по рецепту или без рецепта (OTC), и иногда некоторые производители продавали лекарство только по рецепту, в то время как другие продавали тот же препарат без рецепта. Однако теперь производители были подвержены значительной неопределенности, поскольку им приходилось гадать, будет ли FDA рассматривать лекарство только по рецепту или без рецепта. Если производитель думал, что потребители могут правильно использовать лекарство, и поэтому маркировал его и продавал без рецепта, FDA могло не согласиться, удалить продукт и подать в суд на производителя за неправильный брендинг.Действительно, если пациент злоупотреблял лекарством, даже преднамеренно, производитель несет всю вытекающую из этого юридическую ответственность. Разделенная власть стала душить предпринимательство. Беспорядок продолжался до 1951 года, когда Конгресс принял поправку Дарема-Хамфри (см. Ниже).
Закон 1938 года также расширил полномочия FDA в отношении медицинских устройств. Хотя FDA не могло предотвратить появление на рынке медицинского устройства, как это могло быть сделано для лекарств, оно имело право просить суды прекратить производство или продажу устройств, уже введенных в межгосударственную торговлю.Под этим руководством FDA удалило с рынка ряд шарлатанских устройств (Higgs 1995c).
Поправка Дарема-Хамфри, 1951 г.
Поправка Дарема-Хамфри провела более четкое юридическое различие между лекарствами, отпускаемыми только по рецепту, и лекарствами, отпускаемыми без рецепта, и разрешила FDA классифицировать лекарства соответственно. Многие важные лекарства можно было продавать только по рецепту лицензированного врача. Таким образом, лицензированные врачи стали заместителями и неудачниками в растущей системе контроля. Потребителям пришлось заплатить за препарат и визит к врачу.Эти новые привилегии для врачей были наградой правительства за регулирование фармацевтической промышленности и посягательство на свободу потребителей заниматься самолечением. Зависимость от врачей была дополнительно узаконена и узаконена за счет затруднения получения информации потребителями, в частности, путем контроля маркировки и рекламы, который запрещал информацию или требовал неразборчивости. Таким образом, лицензированные врачи приобрели богатство и относительный статус, лишив других свободы и принижая потребителей.(Согласно этой поправке производители по-прежнему имели право по своему усмотрению классифицировать уже одобренные препараты, не вызывающие привыкания, которые должны были перейти под контроль FDA в 1962 году.)
Поправки Миллера о пестицидах 1954 г.
Эти поправки требовали предварительного утверждения остатков пестицидов в пищевых продуктах или на них.
Поправка 1958 года о пищевых добавках
Поправка о пищевых добавках требует допуска пищевых добавок на рынок. Позже FDA использовало эти полномочия для регулирования пищевых добавок, но эти полномочия были отменены Законом о пищевых добавках и здравоохранении (DSHEA) 1994 года.
Изменения в добавках к красителям от 1960 г.
Поправки к добавкам красителей требуют допуска на рынок красителей. Так называемая антираковая статья Делани запрещает FDA одобрять любую красящую добавку, которая, как было установлено, вызывает рак у людей или животных, независимо от уровней дозировки. В результате вещества, вызывающие рак при приеме крысами дозы, в сотни или тысячи раз превышающей обычную для человека, были запрещены в пищевых продуктах. (См. Wildavsky 2000 о ненадлежащем использовании исследований на животных для регулирования канцерогенов.)
Поправки Кефовера-Харриса 1962 г.
В эпоху после Второй мировой войны фармакология вступила в новую эру. Людей с бактериальными заболеваниями теперь можно было лечить множеством новых антибиотиков, а диабетикам было дано спасительное изобретение инсулина. В частности, в 1950-х годах многие новые лекарства были названы «волшебными пулями» из-за их эффективности и быстрого поражения болезни. Однако сам успех новых лекарств стимулировал введение новых правил.
Сенатор Эстес Кефовер, входивший в состав подкомитета Сената по антимонопольному законодательству и монополиям, решил, что, имея дело с лекарствами, правительство должно делать больше, чем просто контролировать их этикетки, содержимое и безопасность, а также их процессы маркетинга и распределения.Он также должен контролировать их цены и обеспечивать «конкуренцию». В 1960 году Кефовер инициировал слушания, пытаясь разоблачить недобросовестную маркетинговую практику. В законопроекте Кефовера содержится призыв к схеме обязательного совместного использования патентов. Каждая фармацевтическая компания через три года должна будет делиться своими новыми патентами с конкурентами, собирая при этом ежегодный гонорар в размере около 8 процентов от общей суммы. Хотя Кефовера больше всего беспокоило ценообразование, еще одно положение требовало от соглашений о неразглашении доказательств их безопасности и эффективности.
Хотя президент Кеннеди с любовью отзывался о клаузуле «безопасность и эффективность», законопроект Кефовера не пользовался популярностью и ни к чему не привел. Как и в случае с действиями 1902, 1906 и 1938 годов, новая трагедия проложила путь к проходу. Трагедия была такой грандиозной, такой болезненной и настолько шокирующей, что до сих пор вызывает сильные эмоции и останавливает интеллектуальный дискурс.
В 1957 году западногерманский производитель фармацевтических препаратов представил новое седативное средство — талидомид, облегчающее симптомы утреннего недомогания у женщин в первом триместре беременности.В 1962 году, когда лекарство было продано в сорока шести странах, стало ясно, что талидомид повреждает плод, вызывая мертворождение или, чаще всего, phocomelia (по-гречески «конечность тюленя»). У тысяч новорожденных были усеченные конечности, напоминающие ласты. Благодаря фотожурналистике ужас и печаль разделили весь мир.
В США NDA для талидомида было подано в FDA в 1960 году, но одобрение было отложено, поскольку FDA исследовало побочные неврологические реакции.Представители FDA даже не подозревали, что препарат вызывает врожденные дефекты. В 1962 году президент Кеннеди вручил награду за выдающиеся заслуги на федеральной гражданской службе Фрэнсис Келси, врачу FDA, получившему одобрение, хотя ее отказ в одобрении был скорее вопросом бюрократических проволочек, чем следствия (Harris 1992).
«Младенцы с талидомидом» стали дубинкой для призывов к более решительным действиям правительства. Законопроект Кефовера был пересмотрен, так что положения о ценообразовании и совместном использовании патентов были удалены, а поправки Кефовера-Харриса вскоре были приняты.Поправки разрешили FDA требовать от фармацевтических компаний проведения и представления тестов, определяющих безопасность и эффективность. Кроме того, теперь FDA должно было проводить преклир всех испытаний на людях, рекламы и маркировки лекарств. FDA также увеличило свои регулирующие полномочия в сфере производства.
Поправки 1962 года значительно сократили выбор врачей и пациентов и расширили полномочия FDA, которое увеличило свой штат с тысячи членов в 1951 году до почти шестидесяти пятисот два десятилетия спустя (Temin 1980, 121).Помимо требования тестирования эффективности новых лекарств, FDA с помощью Национальной академии наук по реализации исследования эффективности лекарств начало исследование эффективности имеющихся на тот момент запасов лекарств.
Задача доказательства эффективности намного сложнее, дороже и требует много времени, чем задача доказательства безопасности. В значительной степени эффективность, которая зависит от индивидуальных условий и опосредована рыночным процессом, в прошлом всегда оценивалась совместно врачами и потребителями.Об эффективности препарата следует судить относительно альтернативных методов лечения, и поэтому он постоянно меняется, обнаруживается и подтверждается опытом медицинского рынка с использованием постмаркетингового наблюдения и исследований. Безопасность, естественно, всегда требует серьезных предварительных гарантий. Но поиски повышения эффективности в некоторой степени продолжались людьми, которые служили друг другу подопытными кроликами, и в результате быстро прогрессировал. Однако в 1962 году FDA начало действовать, исходя из предпосылки, что оно может установить авторитетные знания об эффективности до опыта и экспериментов с реальными рыночными процессами.
Время, потраченное на ожидание одобрения FDA, а также расходы и продолжительность бюрократически определенных процедур тестирования в совокупности приводят к огромным задержкам в разработке и производстве лекарств. После 1962 года разработка лекарств значительно снизилась, а ожидание появления новых жизненно важных лекарств увеличилось до более чем десяти лет к концу 1970-х годов (см. «Вред FDA» ниже).
Роль талидомида в принятии поправок 1962 года пронизана досадной иронией. Во-первых, этот эпизод вызвал у общественности большое сочувствие к человеческим страданиям, но никто не подумал о страданиях, которые должны были возникнуть в результате все более ограниченного контроля над разработкой, доступностью и информацией лекарств.Во-вторых, люди ссылались на талидомид, утверждая, что отсрочка одобрения препарата — это благо, но FDA до 1962 года оказалось достаточно медленным, чтобы избежать вреда талидомида в Соединенных Штатах. В-третьих, старый закон 1938 года уже требовал предварительного одобрения для обеспечения безопасности. Ничего подобного в отношении эффективности талидомида даже поверхностно не рекомендовано на премаркете.
Поправки к лекарствам для животных от 1968 г.
Эти поправки требовали предварительного утверждения новых лекарств и кормовых добавок для животных.
Дополнения к медицинскому оборудованию от 1976 г.
Как и в случае с лекарствами, область медицинских устройств вступила в новую эру после Второй мировой войны. В этот период были внедрены кардиостимуляторы, почечные катетеры, заменяющие суставы и многие другие инновации. FDA сначала попыталось отрегулировать эти новые продукты, реклассифицировав их как лекарства, но в обычной истории потребовалась трагедия, на этот раз из-за неисправной ВМС Dalkon Shield, чтобы выработать новый закон.
Поправки 1976 г. расширили определение медицинского устройства и разрешили FDA разделить все медицинские устройства на три класса.Устройства класса I — например, отжиматели языка и марля — подлежат отчетности и правилам надлежащей производственной практики (GMP). Устройства класса II подлежат тому же контролю, что и устройства класса I, и тем же стандартам производительности для конкретных продуктов, предположительно разработанным FDA (см. Ниже). Устройства класса III — например, искусственные сердца и катетеры для ангиопластики — должны пройти процесс утверждения FDA, аналогичный тому, который требуется для новых лекарств; то есть, прежде чем можно будет начать маркетинг, устройства класса III должны быть подтверждены безопасностью и эффективностью в ходе обширных клинических испытаний, а также должны пройти предпродажный процесс утверждения FDA.
Прекрасный пример мышления FDA: новых устройств автоматически классифицируются как наиболее опасные устройства, то есть устройства класса III, независимо от фактического риска. (См. Некоторые примечания о медицинских устройствах, чтобы узнать о абсурдных последствиях этой процедуры.) Новое устройство может не пройти предпродажную процедуру утверждения, если будет продемонстрировано, что оно «в значительной степени эквивалентно» устройству до внесения поправок (и, поскольку безопасные медицинские устройства Закон [SMDA] от 1990 года в отношении любых продаваемых в настоящее время устройств, не относящихся к Классу III).Предполагается, что «в значительной степени эквивалентные» устройства могут пройти более простой процесс предварительного уведомления (в отличие от утверждения), известный как маршрут 510 (k), после этого раздела Закона 1976 года.
Четкая классификационная схема поправок к медицинскому оборудованию не описывает фактическую практику FDA. Например, FDA не разрабатывало никаких стандартов производительности до 1997 года! Таким образом, устройства класса II не играли роли в разработке медицинских устройств до недавнего времени, и еще неизвестно, станут ли они более распространенными в будущем.(Требования к устройствам класса II были ослаблены Законом о безопасных медицинских устройствах 1990 года.) Кроме того, «простая» процедура 510 (k) превратилась в длительный и трудоемкий процесс предварительного утверждения. (Реальность была признана в SMDA, который формально превратил процесс 501 (k) в процесс утверждения.)
Munsey (1995) дает хороший обзор регулирования медицинских устройств.
Закон о контроле над токсичными веществами 1976 г.
Этот закон требовал предварительного уведомления о химических веществах.
Закон 1980 года о детских смесях
Закон о детских смесях 1980 года был принят после того, как у 31 ребенка была диагностирована проблема, связанная с дефицитом хлорида в определенной марке детских смесей на основе сои. После первоначального отчета о трех детях от врача, который подозревал проблему с соевой смесью, FDA работало удивительно быстро, консультируясь с педиатрами и производителем, чтобы оценить и выявить проблему. В течение одной недели после первоначального отчета производитель инициировал добровольный отзыв (CDC 1999).История показывает FDA в лучшем и самом полезном виде. К сожалению, в ответ на это событие Конгресс постановил, что детские смеси больше не могут продаваться без предварительного одобрения FDA. В результате стало трудно и дорого получить одобрение новых детских смесей. Параллельно с проблемой задержки в приеме лекарств у нас теперь есть проблема задержки в питании детским питанием (пример которой можно найти, перейдя по ссылке).
Закон о лекарственных средствах от сирот 1983 г.
К 1983 году исследование, тестирование и разработка нового лекарства могли занять до двадцати лет, семь из которых истекали в ожидании окончательного утверждения FDA NDA.(Более свежие данные о среднем времени см. Ниже в разделе «Процесс разработки и утверждения лекарств».) Повышенная осведомленность о пациентах, с нетерпением ожидающих лечения, привела к реформе. Поскольку затраты на получение одобрения FDA были одинаковыми независимо от того, составлял ли прогнозируемый рынок два миллиона пациентов или двадцать тысяч пациентов, компании, естественно, продолжали, при прочих равных условиях, разработку методов лечения для крупных рынков и заброшенный (или «осиротевший») малый рынок. терапии. Таким образом, регулирование FDA имело особенно негативные последствия для людей, страдающих редкими заболеваниями.Закон о лекарствах для сирот был создан с целью сократить потери лекарств от «редких» заболеваний, которые, как было определено, имеют менее двухсот тысяч случаев в Соединенных Штатах. Закон о лекарствах для сирот предоставил налоговые льготы, субсидии и особые привилегии спонсорам лекарств от редких заболеваний.
Вместо того, чтобы снижать барьеры FDA для производства орфанных лекарств, Закон о орфанных лекарствах был призван стимулировать разработку таких лекарств путем предоставления спонсорам новых монопольных привилегий. Эксклюзивность, предоставляемая по закону, отличается от патента.Патент защищает от конкуренции лекарство с такой же химической структурой. Эксклюзивность на рынке, закрепленная в Законе о лекарствах для сирот, обеспечивает защиту на семь лет от конкуренции со стороны любого лекарства с аналогичным эффектом. Таким образом, FDA запрещает фирмам продавать лекарства, которые лечат болезни, которые также лечатся (и, возможно, менее эффективно) с помощью эксклюзивных препаратов.
Должностные лица заявляют, что эта акция увенчалась успехом, отмечая, что почти тысяче лекарств был присвоен статус сирот.Однако количество таких наркотиков вводит в заблуждение, потому что многие из них были бы произведены даже без этого закона. Кроме того, управление актом требует нескольких уловок. Больных раком насчитывают миллионы, но лекарству может быть предоставлен статус сироты для лечения рака яичников или рака мочевого пузыря. Таким образом, лекарство, используемое для лечения рака яичников и мочевого пузыря, может оказаться сиротой в каждой категории, даже если общая численность населения, обслуживаемого этим лекарством, будет более двухсот тысяч. Еще более абсурдно то, что рынок лекарства можно разделить на категорию профилактики и категорию лечения, и, если число пострадавших в любой из категорий меньше двухсот тысяч, предоставляется статус сироты.Более того, одно и то же лекарство может стать сиротой более чем от одной болезни, увеличивая его монопольные привилегии (Arno, Bonuck, and Davis 1995).
История Закона о лекарствах для сирот свидетельствует об интересном расширении преимуществ для производителей лекарств. Первоначально стандартом для статуса сирот было «отсутствие разумных ожиданий, что затраты на разработку будут возмещены за счет продаж в США». Поскольку мировые продажи часто намного превышают продажи в США, даже этот стандарт может предоставлять исключительность, субсидии и налоговые льготы для лекарств, которые по-прежнему были бы прибыльными без таких льгот.Чтобы доказать, что не было разумных ожиданий возмещения затрат, фармацевтические фирмы должны были предоставить финансовые данные в IRS. Однако фармацевтической промышленности это положение не понравилось, и они лоббировали его ослабление. В 1984 году стандарт статуса сирот был ослаблен, и теперь в США было менее двухсот тысяч потенциальных пациентов на момент запроса о присвоении статуса сирот. В первые годы СПИДа, когда болезнь затронула сравнительно небольшое количество людей, пересмотренный стандарт позволил многим лекарствам от СПИДа получить статус сирот, несмотря на то, что ожидалось, что рынок этих лекарств будет быстро расти.АЗТ был признан орфанным препаратом, несмотря на то, что его продажи достигли миллиардов долларов. Первоначально Конгресс также ограничил исключительность лекарствами, которые не могли быть запатентованы; это ограничение было снято в 1985 году. Таким образом, со временем Закон о лекарствах для сирот стал значительно более выгодным для признанных производителей лекарств в США.
Спонсор, желающий получить статус сироты для препарата, не обязательно должен быть его создателем, и препарат не обязательно должен быть новым. Препарат оксандролон использовался для лечения истощения у пациентов с гепатитом и отпускался по рецепту в течение тридцати лет.Когда бодибилдеры начали использовать его нелегально для увеличения объема, препарат получил плохую огласку и был прекращен. Затем другая компания получила права на препарат и представила его FDA как новое средство от истощения, связанного с ВИЧ. Присвоен статус сироты. Пациенты со СПИДом теперь платили цену на 1200 процентов выше, чем когда производитель не обладал монопольными правами (LeBlanc and Sabados 1996).
На первый взгляд, Закон о лекарствах для сирот выглядит как один из примеров, когда политики осознали некоторые проблемы, вызванные ограничениями, и предприняли шаги по их исправлению.Однако этот закон не отменяет ограничения, а скорее предоставляет новые полномочия FDA и вводит новые гаечные ключи в дела частного сектора. Сторонники закона FDA без существенных доказательств заявляют, что решают проблему. К сожалению, до сих пор не проводился серьезный анализ затрат и выгод для определения чистых последствий этого акта.
Закон Ваксмана-Хэтча 1984 г.
Если правительство США выдает патент на лекарство, всем другим производителям запрещается в течение заранее определенного количества лет производить продукт с таким же химическим составом (за исключением франшизы от патентообладателя).Патент, таким образом, предоставляет держателю патента некоторую монопольную власть. Обычный срок действия патента — семнадцать лет. При разработке нового лекарства компания обеспокоена возможностью того, что другая компания также работает над этим лекарством (или получила новости или утечки о многообещающем зарождающемся лекарстве) и стремится получить патент. Поэтому компании подают заявки и получают патенты на лекарства до окончательного утверждения FDA для продажи лекарства.
Но часть семнадцатилетней патентной защиты растрачивается в ожидании утверждения.«Эффективный срок действия патента» нового лекарства — это время от утверждения до окончания срока действия патента. По истечении срока действия патента другим производителям разрешается копировать продукт и продавать его как «непатентованный препарат». Эта конкуренция снижает цены.
В течение 1970-х и 1980-х годов продолжительность требований FDA продолжала расти, сокращая эффективный срок действия патента. Поэтому фармацевтические компании столкнулись не только с большими затратами на разработку лекарств и задержками, но и с сокращением патентной защиты продуктов, которые в конечном итоге вышли из-под контроля FDA.Они были зажаты с обоих концов.
Комиссии, учрежденные президентами Картером и Рейганом, рекомендовали скорректировать условия патентов, чтобы компенсировать время, потерянное на рассмотрение регулирующих органов. Однако производители дженериков воспротивились этой идее. Обойти их возражение оказалось невозможным. Так родился двусторонний закон 1984 года о конкуренции цен на лекарства и восстановлении срока действия патентов, известный как Закон Ваксмана-Хэтча. Этот акт послужил производителям дженериков, сняв некоторые произвольные и абсурдные ограничения на производителей дженериков.До принятия закона производителю дженериков было недостаточно доказать, что его лекарство биоэквивалентно одобренному лекарству. Вместо этого производитель должен был предоставить независимую информацию о безопасности и эффективности. Таким образом, производителю дженериков пришлось повторить многие клинические испытания, проведенные первоначальным производителем, несмотря на то, что можно было доказать, что лекарства являются биоэквивалентными. Из-за затрат на проведение клинических испытаний многие лекарства не сталкивались с конкуренцией со стороны генериков даже после истечения срока действия соответствующих патентов.Закон требовал, чтобы FDA признало биоэквивалентность достаточной для утверждения (то, что FDA могло бы сделать до принятия закона). Процедура утверждения непатентованного лекарства называется сокращенной заявкой на новый лекарственный препарат (ANDA).
Либерализация утверждения непатентованных лекарств была стимулом для компаний-производителей дженериков, необходимых для поддержки второй части закона, корректировки срока действия патента. Waxman-Hatch продлевает срок действия патентов на время, потерянное во время проверки FDA, и на половину времени, потерянного во время клинических испытаний, требуемых FDA.Продление ограничено максимум пятью годами, а общий срок действия патента ограничен четырнадцатью годами с даты утверждения FDA. До принятия закона эффективный срок действия патента составлял примерно от семи до десяти лет. Waxman-Hatch продлил патенты в среднем на два-три года, а эффективный срок действия патента составляет примерно девять-двенадцать лет (Grabowski and Vernon 1996). Хотя патентный закон предоставляет семнадцать лет срока действия патента, срок действия патента, превышающий десять лет, обычно имеет низкую ценность, поскольку появление новых лекарств снижает ценность старых лекарств, запатентованных или нет.
Закон об экспорте лекарств 1986 года с поправками
FDA запретило американцам экспорт лекарств, не одобренных в США. Таким образом, патернализм FDA распространялся не только на граждан США, но и на людей во всем мире. Некоторые фирмы переместили заводы за границу, чтобы избежать ограничений. Ограничения на экспорт также способствовали потере лекарств, поскольку они сделали разработку лекарств в США менее прибыльной. Закон 1986 года о внесении поправок в Закон об экспорте лекарств либерализовал У.С. экспорт таких препаратов.
Согласно закону, экспорт разрешен, если лекарство (не одобренное FDA) удовлетворяет трем условиям: (1) активно запрашивается одобрение США; (2) на препарат также распространяется исключение в отношении расследования в США; и (3) препарат предназначен для экспорта в любую из двадцати одной страны, которая одобрила это лекарство и имеет нормативные программы, соответствующие стандартам США (стандарты, то есть нормативные программы другой страны, не обязательно стандарты FDA для лекарственных средств). контроль) (Каплан 1995).
Закон о маркировке пищевых продуктов и образовании (NLEA) 1990 г.
NLEA требует, чтобы производители пищевых продуктов включали маркировку пищевой ценности на большинство пищевых продуктов. (По иронии судьбы, такая маркировка была незаконной до начала 1970-х!) Закон добавил такие вещи, как насыщенные жиры, холестерин, общие и подгруппы углеводов, а также пищевые волокна в список питательных веществ, которые должны быть указаны на этикетках пищевых продуктов. Хотя мясо и птица остаются под контролем Министерства сельского хозяйства США, FDA имеет полномочия над формой и содержанием дескрипторов питательных веществ для большинства пищевых продуктов.NLEA также кодифицировал полномочия FDA разрешать заявления о пользе для здоровья в отношении пищевых продуктов и пищевых добавок. Хотя намерение NLEA состояло в том, чтобы увеличить объем информации, получаемой потребителями, путем расширения заявлений о вреде для здоровья, разрешенных в отношении пищевых продуктов и пищевых добавок, официальные лица FDA заняли агрессивную позицию и объявили, что они планируют регулировать добавки как лекарства. Возникшая в результате негативная реакция привела к принятию Закона о пищевых добавках и здоровье и образовании (DSHEA) 1994 года.
Закон о безопасном медицинском оборудовании (SMDA) 1990 г.
SMDA существенно повысило требования к отчетности для медицинских устройств, включая требование к пользователям устройств сообщать о побочных эффектах в FDA и производителям устройств.Отчеты по медицинскому оборудованию требуют обширных и дорогостоящих документов, зачастую не имеющих особой ценности. SMDA также официально изменило процедуру 510 (k), которая изначально задумывалась как процедура уведомления, на процедуру предварительного утверждения. Вплоть до этого закона FDA никогда не издавало никаких стандартов производительности класса II, поэтому SMDA изменило требования, облегчив FDA установление стандарта; он также предусматривал, что устройства класса II могут быть выданы, если они сопровождаются «специальными средствами контроля».«Специальные меры контроля включают послепродажное наблюдение и другие меры, которые FDA может счесть необходимыми. SMDA также разрешило оценку существенных гражданских наказаний за нарушение Закона о пищевых продуктах, лекарствах и косметических средствах в отношении устройств.
Munsey (1995) дает хороший обзор регулирования медицинских устройств.
Закон о пошлинах для потребителей рецептурных лекарств (PDUFA) 1992 г.
Данные, полученные до 1992 г., показали, что в среднем FDA требовалось два с половиной года для рассмотрения NDA, а иногда и до восьми лет.Часто причиной задержки была не сложность приложения, а просто отставание. Заявления оставались без рассмотрения месяцами или даже годами. FDA пришло к выводу, что процесс утверждения можно было бы ускорить, если бы у них было лучшее оборудование и больше рабочих для рассмотрения заявок. Однако Конгресс не желал увеличивать ассигнования FDA. Так родился Закон 1992 года о пошлинах для потребителей рецептурных лекарств, устанавливающий на пятилетний период обязательную плату в размере примерно 200 000 долларов, которую фармацевтическая компания должна подавать вместе с заявлением.FDA наняло сотни новых сотрудников. В результате принятия законодательства среднее время обработки сократилось вдвое, до восемнадцати месяцев. Из-за этого очевидного успеха Закон о модернизации 1997 года продлил эту практику еще на пятилетний период и увеличил плату за пользование. Необходимость обновления PDUFA каждые пять лет вынудила FDA оптимизировать свои процессы, чтобы производители лекарств поддержали обновление. Другими словами, возможная угроза потери платы с пользователей и, следовательно, необходимости сокращения штата и других преимуществ, по-видимому, сделала бюрократический аппарат FDA более эффективным и приспособленным к потребностям клиентов.
В 2002 году Конгресс повторно санкционировал закон, и FDA выпустило PDUFA III, свой пятилетний план, до 2007 года. Этот план расширил PDUFA I и II, позволив взимать плату с пользователей за надзор за безопасностью лекарств после утверждения в ответ на Отчет GAO и озабоченность Конгресса тем, что ресурсы сокращаются из-за неутвержденных действий в FDA. Это также предусматривало финансирование увеличения количества сотрудников примерно на тридцать процентов. PDUFA IV, текущий пятилетний план после повторной авторизации в 2007 году, продолжает расширение охвата FDA постмаркетной безопасности лекарств и позволяет нанимать дополнительных сотрудников.FDA рассчитывает собирать дополнительно 29 миллионов долларов в год в качестве платы с пользователей для поддержки этих усилий. Дополнительное финансирование повысит способность FDA выявлять проблемы с безопасностью послепродажного обслуживания, но не имеет отношения к первоначальным целям PDUFA. Вместо этого новые сборы действуют как еще один механизм финансирования для FDA, и увеличение финансирования будет использоваться для поддержки пострыночной деятельности, разработки передовых методов и обеспечения более быстрого утверждения и согласования патентованных наименований лекарств.
Проверка PDUFA 2002 г., проведенная GAO, показала, что доходы от платы за пользование и требования к производительности PDUFA позволили FDA быстрее одобрить некоторые лекарства.GAO обнаружило, что между 1993 и 2001 годами время утверждения стандартных или неприоритетных препаратов сократилось с двадцати семи до четырнадцати месяцев, в то время как срок утверждения приоритетных препаратов оставался на уровне шести месяцев. Однако GAO обнаружило, что сейчас лекарства проходят больше циклов проверки (например, количество разрешенных к применению циклов снизилось с 51% до 37% в период с 1998 по 2001 год). Управление по санитарному надзору за качеством пищевых продуктов и медикаментов может отклонять заявки, которые в противном случае могли бы быть в конечном итоге одобрены, чтобы соответствовать требованиям к скорости обработки, введенным в законе о модернизации 1997 года, что снижает очевидный выигрыш в эффективности.В отчете GAO также отмечалось, что за этот период объем изъятия лекарств увеличился, хотя и не обязательно из-за каких-либо проблем, вызванных PDUFA, и рекомендовалось приложить больше усилий для постмаркетингового надзора, что привело к некоторым расширениям в PDUFA III и IV.
Philipson et al. (2005) и Berndt et al. (2005) представляют наиболее сложный анализ затрат и выгод PDUFA. Они обнаружили, что PDUFA действительно увеличил прибыль производителя и сократил время проверки FDA. Более того, они не находят доказательств того, что безопасность снижалась при использовании PDUFA.Самое главное, более быстрое время проверки означало большую выгоду для потребителей, которую они оценивают как эквивалент экономии от 180 до 310 тысяч лет жизни.
Закон о здравоохранении и образовании о пищевых добавках (DSHEA) 1994 г.
FDA на протяжении десятилетий пыталось регулировать продажу и использование витаминов, трав и других пищевых добавок. По закону любой проглоченный продукт, предназначенный его производителем для профилактики или лечения заболевания, является лекарственным средством. Продукты, кроме «пищи», которые предназначены для воздействия на структуру или функции организма, также считаются лекарственными средствами.На протяжении 1950-х и 1960-х годов FDA возбудило сотни судебных исков против производителей пищевых продуктов за предъявление претензий, связанных со здоровьем, в отношении их продуктов. Под угрозой закона производителям продуктов питания даже запретили маркировать жир, холестерин или другую пищевую ценность в своей пище! (Позже такая маркировка была разрешена, а с принятием Закона 1990 года о маркировке пищевых продуктов и образовании маркировка пищевых продуктов стала обязательной.)
FDA активно преследовало розничных продавцов витаминов, которые продавали витамины и другие добавки вместе с книгами или брошюрами, восхваляющими их использование.Например, было незаконно продавать в магазине здорового питания книги о витаминах и , превозносящие достоинства витаминов. FDA оправдало такую практику, которую многие сочли нарушением Первой поправки, теорией, согласно которой литература, которая продавалась рядом с продуктом, была преобразована в продукт , этикетка , и если в литературе были сделаны заявления о пользе для здоровья, тогда продукт должен был регулироваться как лекарство (и, следовательно, должен был пройти клинические испытания FDA перед продажей).
В 1973 году FDA опубликовало правила (вступающие в силу в 1975 году), расширяющие его контроль над добавками, объявив, что любая пищевая добавка, которая, по его мнению, не имеет питательной ценности, является лекарством и, следовательно, находится под контролем FDA. Например, сильнодействующие витамины, под которыми FDA понимало витамины, продаваемые в дозах, вдвое превышающих рекомендованную федеральным законом суточную норму (RDA), ipso facto считались лекарственными средствами (то есть независимо от заявлений производителя или их отсутствия). Высокоэффективные витамины были фактически объявлены незаконными этим постановлением, потому что они не могли продаваться без одобрения FDA, а FDA не одобряло бы добавки, которые считало ненужными.Производители и потребители витаминов сопротивлялись, и в ответ Конгресс принял Поправку к витаминам и минералам Проксмира от 1976 года, в которой говорилось, что FDA не может классифицировать минерал или витамин как лекарство «только потому, что он превышает уровень активности, который [FDA] определяет. является диетически рациональным или полезным »(21 USC 350 [1994, первоначально принятый 1976], [a] [1] [B]).
Стоит прямо указать, хотя для любого, кто следит за сегодняшними новостями в области здравоохранения, это не станет сюрпризом, что многочисленные научные исследования с тех пор подтвердили многие утверждения о пользе для здоровья витаминов и минералов, которые ранее подавлялись Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.Например, подавление FDA информации, касающейся витамина Е и сердечных приступов, может наряду с подавлением информации об аспирине считаться одним из самых смертоносных правил после Второй мировой войны.
В 1985 году FDA проиграло войну за территорию, связанную с Федеральной торговой комиссией (FTC) и Национальными институтами здравоохранения (NIH). По рекомендации Национального института рака, подразделения NIH, Федеральная торговая комиссия разрешила Келлоггу утверждать, что диета с высоким содержанием клетчатки снижает вероятность определенных типов рака.FDA хотело подать в суд на Kellogg, но FTC утверждало, что в рекламе были представлены «важные рекомендации в области общественного здравоохранения точным, полезным и обоснованным образом» (цитата из Calfee 1997, 25). Под давлением FDA отступило, и в результате было установлено, что пищевые продукты могут рекламировать «обоснованные» утверждения о пользе для здоровья без прохождения процесса утверждения лекарств FDA.
Под защитой Поправки Проксмайра индустрия диетических и пищевых добавок расширилась, но FDA снова усилило контроль в начале 1990-х годов после того, как тридцать восемь смертей были приписаны L-триптофану, аминокислоте, широко используемой для лечения депрессии и наращивания мышечной массы. мышечная масса.(Центры по контролю за заболеваниями позже реабилитировали L-триптофан в случаях смерти, вызванной контаминантом, но FDA не сняло запрет на безрецептурные продажи L-триптофана (Beisler 2000). В 1993 году FDA объявило, что оно планировалось регулировать в качестве лекарств все аминокислоты, травы и другие добавки, включая волокна и рыбий жир. Вскоре FDA оказалось под яростной атакой миллионов потребителей пищевых добавок. DSHEA, принятый в 1994 году и вступивший в силу в 1996 году, недвусмысленно требовал от FDA отозвать предварительное уведомление о добавках.
Согласно DSHEA, пищевые добавки могут делать обоснованные «заявления о нутритивной поддержке», которые не требуют контроля FDA. Однако пищевые добавки не могут заявлять о заболеваниях, если они не регулируются как лекарственные препараты. Различие между заявлениями о нутритивной поддержке и заявлениями о болезни нечеткое. Например, производители зверобоя могут утверждать, что зверобой «способствует здоровому эмоциональному равновесию и благополучию», но они не могут сказать, что зверобой.Зверобой «полезен при лечении депрессии». Разница в основном предназначена для юристов, а не потребителей, учитывая, что многие потребители принимают зверобой от депрессии. (Такие потребители действительно имеют право поступать так; ряд исследований показывает, что зверобой не только эффективен в облегчении легких случаев депрессии [например, Woelk 2000], но и дает меньше побочных эффектов, чем многие антидепрессивные фармацевтические препараты. Кроме того, зверобой значительно дешевле фармацевтических препаратов и не требует рецепта.)
Пищевые добавки, содержащие заявления о пищевой ценности, должны иметь следующие два заявления об отказе от ответственности: «Это заявление не было проверено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов». Этот продукт не предназначен для диагностики, лечения или предотвращения каких-либо заболеваний ». В разделе «Варианты реформирования» мы предлагаем использовать первый отказ от ответственности и распространить этот подход с разделенной этикеткой на собственно лекарственные препараты. Второй отказ от ответственности не является информативным.
При соблюдении определенных условий, например, что представленная информация не является ложной или вводящей в заблуждение и не является предвзятой в пользу конкретного производителя или бренда, DSHEA также ограничивает способность FDA запрещать распространение информации о пищевых добавках (Pinco and Rubin 1996 ).Например, розничные продавцы здорового питания теперь могут продавать книги, журналы и научные статьи, описывающие использование пищевых добавок. В результате в последние годы потребители стали намного лучше информированы о роли витаминов и других добавок в обеспечении оптимального здоровья.
Полный текст DSHEA можно найти здесь.
Закон о модернизации Управления по санитарному надзору за качеством пищевых продуктов и медикаментов 1997 г.
К концу 1990-х годов многочисленные академические исследования и правительственные отчеты предъявили FDA обвинения в задержке приема лекарств и их потере.В конце концов, давление в пользу реформ стало ощущаться в Конгрессе, часть которого недавно пообещала дерегулирование в своем «Контракте с Америкой». В 1996 году Палата представителей США написала законопроект о реформе FDA, который серьезно поставил бы под угрозу некоторые из центральных полномочий FDA, но FDA и его сторонники в администрации Клинтона «сделали все возможное, чтобы победить его» (Miller 2000, 55). Столкнувшись с вето и противодействием, Конгресс отказался от серьезного законопроекта. В следующем году они приняли значительно смягченный закон — Закон о модернизации FDA 1997 года.
Большая часть Закона о модернизации просто кодифицировала то, что уже было практикой FDA (Miller 2000). Например, он уполномочивает FDA назначать группы научных экспертов для оказания помощи агентству в оценке новых лекарств — практике, которой FDA следовало на протяжении десятилетий. Точно так же он кодифицировал правило, согласно которому только одно адекватное и хорошо контролируемое клиническое исследование и только подтверждающие доказательства могут быть основанием для утверждения. Поскольку FDA всегда обладало такой гибкостью, но редко ее применяло, влияние правила, вероятно, будет незначительным.Закон также кодифицировал ограничительную политику FDA по распространению информации об использовании лекарств не по назначению. (Впоследствии Вашингтонский юридический фонд против Фридмана счел такие ограничения неконституционными и расширил возможности фирм по распространению информации.) Что касается медицинских устройств, Закон о модернизации освободил большинство устройств класса I и класса II от допуска на рынок и расширил полномочия врачей для использования в исследовательских целях. устройств. Наконец, в ряде статей от FDA требовалось предоставлять производителям более точную и своевременную информацию о своих процедурах.
Наиболее важными положениями этого закона были повторное разрешение на взимание платы с пользователей еще на пять лет и новые стимулы для производителей лекарств к проведению педиатрических исследований. Следуя модели, установленной Законом о лекарствах для сирот, этот закон вознаграждает развитие информации об использовании в педиатрии с монопольными привилегиями. В соответствии с Законом о модернизации спонсору, который занимается разработкой педиатрической информации, предоставляется шесть месяцев эксклюзивных маркетинговых привилегий в дополнение к любым патентам или другим непатентным правам, на которые препарат уже может претендовать.Более того, маркетинговые привилегии распространяются на все виды использования препарата, а не только в педиатрии. Как и в случае с Законом о орфанных лекарствах, усиление стимулов к исследованиям и разработке новых лекарств и их использованию в педиатрии также приводит к повышению цен на лекарства. Компромисс мог бы быть стоящим, но никаких исследований по этому вопросу не проводилось.
Сегодня FDA — это обширная организация, состоящая из пятнадцати офисов, включая Управление по нормативным вопросам, Национальный центр токсикологических исследований, Центр оценки и исследований биологических препаратов, Центр устройств и радиологического здоровья, Центр безопасности пищевых продуктов и прикладных технологий. Питание и Центр ветеринарной медицины.В администрации работает девять тысяч сотрудников, которые контролируют и обрабатывают продукцию на сумму 1 триллион долларов в год. Очевидно, что FDA значительно выросло с момента своего создания в Бюро химии.
Расширение FDA за рубежом в 2008 г.
FDA открыло свой первый зарубежный офис в Пекине, Китай, в ноябре 2008 года. Новый офис, наряду с будущими офисами в Шанхае и Гуанчжоу, предназначен для повышения безопасности экспорта в США за счет ускорения сотрудничества в области регулирования между FDA и китайское правительство.FDA планирует иметь тринадцать сотрудников в офисах в Китае, но еще не расширило их обязанности. FDA планирует открыть дополнительные зарубежные офисы в Индии, Центральной Америке, Европе и на Ближнем Востоке. Европейский Союз также расширил свое регулирующее сотрудничество с Китаем, подписав соглашение об обмене информацией и разрешив совместные проверки производителей для обеспечения соблюдения стандартов безопасности.
FDA играет определенную роль в вопросах безопасности продукции во время ряда проблем безопасности, связанных с загрязненными производственными процессами на китайских заводах за последние несколько лет.Хотя в настоящее время масштабы этой новой экспансии за границу ограничены, она может значительно усилить влияние FDA на иностранных экспортеров в Соединенные Штаты путем введения некой формы предпродажного утверждения лекарств иностранного производства, а не реагирования на инциденты, связанные с безопасностью, по мере их возникновения в Соединенных Штатах.
Вытеснение | Wex | Закон США
ОбзорДоктрина преимущественного права относится к идее о том, что верховная власть закона вытесняет закон низшей власти, когда две власти вступают в конфликт.
Федеральное преимущественное правоКогда закон штата и федеральный закон вступают в противоречие, федеральный закон заменяет или вытесняет закон штата в связи с пунктом о верховенстве Конституции. Конст. США искусство. VI., § 2. Преимущество применяется независимо от того, исходят ли противоречащие законы законодательными органами, судами, административными учреждениями или конституциями. Например, Закон об избирательных правах, акт Конгресса, отменяющий конституции штатов, и постановления FDA могут отменять решения судов штата по делам, связанным с лекарствами, отпускаемыми по рецепту.
Конгресс упредил государственное регулирование во многих областях. В некоторых случаях, например, в отношении медицинских устройств, Конгресс отменял все постановления штата. В других случаях, таких как этикетки на рецептурных лекарствах, Конгресс разрешил федеральным регулирующим органам устанавливать минимальные национальные стандарты, но не отменял постановления штата, устанавливающие более строгие стандарты, чем те, которые устанавливаются федеральными регулирующими органами. В тех случаях, когда в правилах или нормативных актах четко не указывается, следует ли применять преимущественное право или нет, Верховный суд пытается следовать намерениям законодателей и предпочитает интерпретации, которые избегают отмены законов штата.
Преимущественное право штата: прямое, прямое и подразумеваемое преимущественное право отказаПодобно федеральным законам и законам штата, законы штата обычно имеют преимущественную силу, когда законы штата находятся в противоречии с местными законами. Таким образом, главный вопрос, на который суды будут стремиться ответить, заключается в том, существует ли вообще конфликт.
Обычно существует 3 типа конфликтов относительно упреждения:
- Прямой конфликт — когда постановление прямо противоречит закону штата
- Экспресс-приоритет — закон штата напрямую противостоит местным властям
- Подразумеваемое упреждение — это происходит, когда 1 из 3 вещей произойдет:
- , когда местное постановление запрещает действие, разрешенное законодательным собранием штата
- , когда местное постановление разрешает действие, запрещенное законодательным собранием штата
- когда есть четкое законодательное намерение, что «поле» вытесняется законом штата
- «Поле» обычно определяется как наличие обширного объема государственного регулирования, которое отражает намерение государства упредить все местные правила, действующие в определенной области.Занятие в этой сфере, вероятно, будет обнаружено, когда закон штата касается области, которая традиционно была делом государства (например, процесс обращения взыскания на закладную).
Подразумеваемое упреждение — спорная доктрина, потому что такое упреждение может быть значительно труднее предотвратить, чем прямое или явное упреждение. Таким образом, в некоторых штатах подразумеваемое упреждение объявлено вне закона. Кроме того, если государство специально санкционирует действие, то местное правительство обычно не может ограничить действие.
Прекращение действия государства: приоритет поля в результате воздействияСуды нашли различные способы определения того, когда законодательный орган штата вытеснил определенную область. В деле Allied Vending Co. против Боуи (1993) , суд провел тест, состоящий из семи частей, чтобы определить, не вмешался ли законодательный орган штата косвенно:
- Существовали ли местные законы до принятия законов штата тот же предмет
- Предусматривают ли законодательные акты общие административные реестры
- Регулирует ли постановление область, в которой разрешен местный контроль
- Предоставляет ли штат в явной форме параллельные полномочия
- Признал ли государственный орган, который применяет / обеспечивает соблюдение закона, законные полномочия на акт
- Был ли рассмотрен конкретный аспект области, подлежащей регулированию, законодательным актом штата.
- Приведет ли существующий двухуровневый процесс регулирования, если бы местные законы не были упразднены, к хаосу и неразберихе
Есть периоды, в течение которых местные постановления будут Как правило, я нарушаю закон штата.Согласно заявлению Город Риверсайд против Центра здоровья и благополучия пациентов Айленд Эмпайр . (2013), если существенные интересы по конкретному вопросу могут варьироваться от местности к местности, суды будут исходить из того, что они должны отдавать предпочтение законности местных постановлений, а не преимущественному праву государства, если только статут штата прямо не запрещает постановление.
год чумы | The New Yorker
Пришлось всего шестьдесят двести. Трамп был взбешен такой мрачной явкой, но произнес свою обычную шумную речь.Поскольку в Оклахоме только что наблюдалось рекордное увеличение числа случаев COVID (), участники были обязаны освободить кампанию Трампа от ответственности за любое разоблачение. Незадолго до того, как Трамп вышел на сцену, у двух офицеров секретной службы и шести сотрудников кампании оказались положительные результаты.
В аудитории был Герман Каин, бывший генеральный директор. Пиццы Крестного отца и бывшего кандидата в президенты, который стал одним из самых известных черных сторонников Трампа. Как и почти все, он был разоблачен.На следующий день он вылетел домой в Атланту, чувствуя себя измученным — «после своих путешествий», как полагала его дочь Мелани Кейн Галло. Был День отца, и она зашла сделать ему подарок. Они обнялись. Она видела его фотографию на митинге и задалась вопросом, почему он не надел маску. Каин проповедовал достоинства социального дистанцирования и мытья рук в «Шоу Германа Каина», веб-сериале, который он вел, и он обычно носил маску на публике. Он сказал ей, что каждый, кто входит в аудиторию Талсы, прошел проверку на температуру — недостаточный.
Галло всю неделю работала со своим отцом над его шоу. К пятнице они оба почувствовали себя плохо, но Каин снял еще одну серию. В окружении американского флага и портрета Рональда Рейгана он выглядел бледным, его глаза слезились. Он процитировал заголовок газеты: «В США ЗА ТРЕТИЙ ДЕНЬ ПАДАЕТ СМЕРТНОСТЬ человек подряд». Он пожаловался, что в других выпусках новостей увеличилось количество случаев заболевания, добавив: «Они никогда не доходят до уровня смертности , падающего на ».
В понедельник оба были достаточно больны, чтобы пойти в клинику на обследование.Каин чувствовал себя слабым, поэтому он ждал у машины, а Галло стоял в длинной очереди. Внезапно он потерял сознание. E.M.S. Грузовик отвез его в E.R. «Они проверили его и сказали, что с ним все в порядке», — вспоминает Галло. Они вернулись в клинику тестирования. Оба были положительными.
Ее случай был легким. 1 июля Каин был госпитализирован. В тот день он написал в Твиттере статью о предстоящем митинге Трампа на горе Рашмор. «Маски не будут обязательными», — написал Каин в Твиттере, одобрительно добавив: « ЧЕЛОВЕК КОРМИЛИСЬ НА !» Это был вызывающий кивок в адрес базы Трампа.Каин умер 30 июля. Ему было семьдесят четыре года.
Для некоторых чиновников здравоохранения Дебора Биркс стала объектом презрения. «Она стала настоящей катастрофой», — сказал бывший глава C.D.C. сказал мне. Эпидемиолог Йельского университета Грегг Гонсалвес написал в Твиттере: «Доктор. Биркс, что ты, черт возьми, делаешь? Что с тобой случилось? Вашим коллегам, живущим с ВИЧ, стыдно ». Биркса обвинили в том, что он позволил некомпетентному и лживому президенту. Ужасное выражение ее лица на брифинге для прессы, когда он предложил ввести дезинфицирующее средство или использовать мощный свет — «внутри тела, что можно сделать через кожу или каким-то другим способом» — стало мемом, подчеркивая, насколько Трамп скомпрометировал ученые.Публика не знала, о чем она говорила наедине.
Биркс призналась коллегам, что потеряла доверие к C.D.C. Она осудила больничные отчеты агентства о COVID , которые основывались на моделях, а не на достоверных данных. ПЕРЕМЕННЫЙ ТОК. Сотрудник Science сообщил, что ежедневный сбор точных итогов во время пандемии невозможен. Но больницы быстро подчинились после того, как Биркс заявил, что запасы ремдесивира могут быть распределены только больницам, которые предоставили стационарные данные COVID .
В августе к целевой группе присоединился доктор Скотт Атлас, нейрорадиолог, научный сотрудник Института Гувера Стэнфордского университета и постоянный сотрудник Fox News. Он был непреклонен в том, что дети должны вернуться в школу, как и Американская академия педиатрии, которая призвала к «безопасному возвращению» в школу осенью, предупреждая о дефиците обучения, физическом или сексуальном насилии дома и депрессии. Это стоило дискуссии, но большинство взглядов Атласа на COVID казались безрассудными. Он настаивал на том, что маски практически не останавливают распространение, и выступал за создание «коллективного иммунитета», позволяя вирусу беспрепятственно распространяться среди людей с более низким риском.Коллективный иммунитет достигается, когда около семидесяти процентов населения имеют эффективные антитела к болезни в результате инфекции или вакцинации.
Когда Атлас добрался до Белого дома, Трамп перестал общаться с другими советниками по вопросам здравоохранения. Коллективного иммунитета можно было добиться, вообще ничего не делая, что стало невысказанной политикой президента. Атлас побудил Трампа и других поверить в то, что пандемия идет на убыль. «Его голос действительно очень приветствуется, когда он борется с той чепухой, которая исходит из Фаучи», — как сообщается, сказал Стивен Мур, экономический советник Белого дома.(Белый дом отрицает, что «президент, Белый дом или кто-либо в администрации преследовали или защищали стратегию достижения коллективного иммунитета».)
Биркс и Атлас рассказали об этом в Овальном кабинете перед Трампом. . Биркс обвинил Атласа в том, что он стоил жизни американцам своими необоснованными теориями. Атлас проклял ее. Биркс, который прослужил в армии двадцать восемь лет, сразу вернул его. Атлас сказал, что молодых, бессимптомных людей не следует проходить тестирование, добавив: «Она просто хочет заблокировать их и не позволить им жить своей жизнью.«Они продолжали кричать друг на друга, но Трампа это не беспокоило, и он не встал ни на одну из сторон. «Для него это все реалити-шоу, — сказал один из коллег Биркса.
После конфронтации Биркс потребовал, чтобы Пенс удалил Атласа, но Пенс отказался. Оперативная группа начала распускаться после того, как Атлас занял место.
Когда Биркс работала в Африке, она и ее главный эпидемиолог Ирам Заиди встречались с президентами и старейшинами деревень по всему континенту, изучая ценность личной дипломатии.Двое ученых решили вместе отправиться в путешествие по Америке. Заражение переместилось с побережья в центр страны. В июне, когда вирус внезапно охватил Техас, Биркс и Заиди отправились в Даллас, чтобы встретиться с губернатором Грегом Эбботтом. Неуверенная реакция Эббота на пандемию привела к атакам со стороны демократов, которые отметили, что уровень смертности резко вырос, когда он снял ограничения слишком рано, и республиканцев, которые назвали его тираном за введение каких-либо ограничений. На пресс-конференции Биркс призвал техасцев маскироваться, особенно молодежь.«Если они общаются со своими родителями, бабушками и дедушками, им следует носить маску», — сказала она. «Никто не хочет передавать вирус другим». Она похвалила Эбботта за закрытие баров, зная, что на него вынуждают полностью открыть экономику. Вскоре Эбботт выдал приказ о маске.
Заиди выросла в Атланте, ее отец был членом C.D.C. статистик. В отпуске они совершали длительные автомобильные поездки, страсть перешла к Заиди. Она любит водить машину — быстро. Когда они уезжали из Далласа, ее остановил государственный солдат.Она делала сто десять.
«Маленькая леди, куда спешить?» он спросил.
Заиди объяснил, что они только что встретились с губернатором Эбботом, и губернатор Нью-Мексико был следующим. «Вы, конечно, узнаете доктора Биркса», — сказала она.
Солдат их отпустил.
Вскоре после их визита в Нью-Мексико губернатор Мишель Лухан Гришам объявила о штрафе в сто долларов за публичное обнажение маски. Биркс и Заиди отправились в Аризону и встретились с губернатором Дугом Дьюси. Биркс объяснил, что даже небольшое увеличение процента позитивности — с 3.5–5% — может спровоцировать неуправляемый кризис. Вскоре Дьюси заявил: «Если вы хотите участвовать в акции любого товара или услуги в Аризоне, вы собираетесь надеть маску».
Биркс и Заиди преодолели двадцать пять тысяч миль, пересекли страну восемь раз, посетив сорок три штата, причем многие более одного раза. Они увидели сельские районы и города, красную Америку и синюю Америку. Они проезжали мимо хлопковых ферм и соевых полей, но они также видели заброшенные нефтяные вышки и заброшенные фабрики, остатки уходящей индустриальной эпохи.Здесь были блестящие города, смелые и блестящие, со строительными кранами, венчающими линию горизонта, и разбитые города, падающие в упадок, из которых истекло все обещание.
Женщины, которые регулярно проходили тестов на COVID , установили свои собственные протоколы. Они чистили арендованные автомобили и номера в мотелях салфетками Clorox. Рано утром в Starbucks забирали кофе и выпечку. Обед часто представлял собой арахисовое масло, намазанное на хлеб пластиковым ножом. Ужин подавали в проездном окне.Бариста и обслуживающий персонал на заправочных станциях были полезными информаторами о вспышках болезней в общинах и служили индикаторами соблюдения местных требований к маскам. Биркс и Заиди встретились с мэрами и общественными организаторами; они посетили больницы и дома престарелых; они превратили H.I.V. активистов в COVID активистов. В Атланте призвали чиновников проверять мигрантов, работающих на птицефермах. Они посетили более тридцати университетов. Те, кто проводил обязательное еженедельное тестирование студентов, имели показатели положительности ниже одного процента; в школах, где тестировались только люди с симптомами, показатели положительности составляли от двенадцати до пятнадцати процентов.Губернаторы-республиканцы и демократы пожаловались на то же: многие люди не слушали, пока Трамп отказывался подавать пример.
Одним из самых эффективных губернаторов, с которыми столкнулись Биркс и Заиди, был Джим Джастис из Западной Вирджинии. Он издал мандат на маску и на брифингах для прессы зачитывал имена жителей Западной Вирджинии, умерших от COVID . Он призвал жителей «быть хорошими, любящими соседями». Штат разработал план безопасного открытия школ путем постоянной оценки уровня риска в каждом округе и представления этих данных на карте с цветовой кодировкой.«Это то, что может сделать каждый округ и каждый штат», — сказал Биркс. «Западная Вирджиния представляет собой именно то, что мы хотим видеть по всей стране — здравый подход, основанный на данных».
Пандемия обнажает слабости общества. Биркс и Заиди видели страну, которая страдала от плохого состояния здоровья еще до атаки COVID , где 40% взрослых страдают ожирением, почти половина — сердечно-сосудистыми заболеваниями, а каждый тринадцатый страдает астмой. Они посетили резервации и встретились с коренными американцами, которые особенно пострадали от вируса COVID .Индейская община Солт-Ривер Пима-Марикопа в Аризоне подарила Бирксу маску с надписью на щите племени Солт-Ривер. Когда в Северной Дакоте был зарегистрирован самый высокий уровень инфицирования в стране, Биркс встретился с губернатором Дугом Бургамом, а также с местными, государственными и племенными чиновниками. Биркс отругал их: «Это наименьших случаев использования масок, которые мы видели в торговых точках, где бы мы ни были». Она добавила: «Все начинается с того, что община и община решают, что важно, чтобы их дети ходили в школу, а община решает, что важно не заразить персонал дома престарелых, который заботится о своих подопечных.В конце концов Бургум согласился на мандат на маску. Губернатор Южной Дакоты Кристи Ноэм не нашла времени на встречу с Бирксом.
В течение почти шести месяцев Биркс загонял в угол политиков, руководителей больниц и чиновников здравоохранения, часто впервые собирая таких лидеров вместе. Она делала диаграммы и слайды от штата к штату, продвигая простое и последовательное сообщение о масках, социальном дистанцировании, прозрачности и ответственном лидерстве. Она была единственным федеральным чиновником, делавшим это.
Однажды в октябре Биркс и Заиди обедали на придорожной остановке в Юте, рядом с соляными равнинами Бонневиль, где часто устанавливаются рекорды наземной скорости. Соль растянулась, как замерзшее море.
Взяли напрокат синий Jeep Wrangler. «Нам нужно уехать по бездорожью, всего на минуту», — сказал Заиди. Биркс смотрел на огромную белую пустоту. «Пока ты никого не ударишь», — сказала она.
17. Dark Shadows
Я спросил доктора Фаучи об исследовании глобальной готовности, в котором Америка названа нацией, лучше всего подготовленной к пандемии.Что случилось? Он издал отчаянный смех и сказал: «Мы так и не вернулись к исходному уровню» — момент, когда заражение было достаточно уменьшено, чтобы можно было отслеживать контакты и минимизировать распространение. «Возможно, у нас не было единой стратегии», — продолжил он. «Это может быть наша собственная культура прямо сейчас, люди не хотят, чтобы им говорили, что им делать. В правилах сказано: «Не ходите в бары. Наденьте маску ». И вы смотрите на фотографии в газетах и по телевизору, и вы видите большие толпы, в основном молодые люди без масок.
Фаучи, который провел niaid через шесть администраций, никогда не видел такого уровня недоверия и гнева в стране. «Политический раскол не поддается согласованному, согласованному и совместному ответу против общего врага», — сказал он. «В обществе также наблюдается отпор всему авторитету, и ученые воспринимаются как авторитеты, поэтому я считаю, что у нас есть антинаучная тенденция, которая ведет к тенденции против вакцинации.«Даже при наличии эффективной вакцины — или нескольких из них — социальное сопротивление может отсрочить долгожданный коллективный иммунитет.
Я спросил Фаучи, не угрожали ли ему. «О, боже мой, — сказал он. «Приставать к жене и детям. Это действительно подло. Это группа людей в даркнете, которые являются ультра-ультра-ультра-ультраправыми сумасшедшими. Они каким-то образом получили номера телефонов моих детей, они отслеживали их, где они работают, они приставали к ним сообщениями, некоторые с угрозами, некоторые непристойными. Нам с женой неоднократно угрожали смертью.Он вздохнул и сказал: «Это то, что есть».
«Покупайте боеприпасы, дамы и господа, потому что их будет трудно достать», — предупредил Майкл Капуто на бессвязном мероприятии в Facebook Live 13 сентября. Капуто — помощник министра здравоохранения и социальных служб, специализирующийся на общественных делах. Он контролирует поток информации из американских учреждений общественного здравоохранения: C.D.C., F.D.A. и N.I.H. Трамп назначил Капуто на этот пост в апреле, когда COVID вышли из-под контроля; компетентность и прозрачность необходимы для восстановления общественного доверия.У Капуто не было опыта в области общественного здравоохранения, и он утверждал, что его лучшим другом был печально известный политический деятель Роджер Стоун.
Очевидно, президент хотел, чтобы Капуто только усилил свое послание о том, что вирус не так опасен, как утверждали ученые, и что кризис находится под контролем. Капуто председательствовал на выступлениях H.H.S. это противоречило руководящим принципам C.D.C. — очевидно, чтобы уменьшить количество дел и остановить поток плохих новостей. Трамп попросил Капуто возглавить кампанию «победить отчаяние», что побудило знаменитостей поддержать подход администрации к невмешательству.Чтобы профинансировать кампанию, Капуто вырвал триста миллионов долларов из бюджета C.D.C.
Тем временем его научный руководитель Пол Александер, по совместительству профессор канадского университета, выдвинул альтернативный план: коллективный иммунитет. «Речь идет только о том, чтобы позволить группам, не относящимся к группе высокого риска, подвергнуться воздействию вируса», — написал Александр Капуто в электронном письме, полученном Политико. «Мы хотим, чтобы они были инфицированы».
Усилия Капуто встретили сопротивление Фаучи и других, и он почувствовал себя в осаде.На видео в Facebook он был небрит, сидя возле своего дома в Буффало. «На это правительство работают ученые, которые не хотят, чтобы Америка стала лучше», — сказал он. «С этого момента и до выборов, должно быть, это все плохие новости». Он смотрел в космос. «Это война. Джо Байден не собирается уступать . Атаки антифа, произошедшие убийства, митинги, переросшие в насилие, — все это практика ».
Такие воинственные мысли разделял Адам Фокс. Сильно сложенный мужчина с аккуратной коричневой бородой и квадратным лицом, он помогал возглавить ополчение под названием «Мичиганский три процента» — ссылка на их веру в то, что только три процента американских колонистов подняли оружие против Британии в Войне за независимость.
В торговом центре в Гранд-Рапидс магазин Vac Shack продает и обслуживает пылесосы. Фокса, бывшего сотрудника, выгнали из дома своей девушки, и он стал бездомным. Хозяин магазина позволил Фоксу поспать в подвале. Именно там он якобы начал заговор с целью похищения Гретхен Уитмер, губернатора Мичигана, которая ввела жесткие меры изоляции.
В июне на митинге за права оружия в Лансинге Фокс встретился с членами ополчения «Стражи росомахи», которые планировали убить полицейских.Их взбесили ограничения Уитмера COVID , но даже до пандемии они были склонны к гневу. «Мне надоело, что меня грабят и порабощают», — пожаловался один из заговорщиков, получив штраф за вождение без водительских прав.
Фокс якобы сказал Сторожам, что набирает команду для операции, нацеленной на столицу штата. Ему понадобилось двести человек, чтобы штурмовать здание и похитить политиков, в том числе Уитмера, которого Фокс называл «сукой-тираном».«Хотя заговорщики в основном были безработными или имели низкооплачиваемую работу, они потратили тысячи долларов на электрошокеры и очки ночного видения и планировали потратить еще тысячи долларов на взрывчатку. Их явно вдохновило пренебрежительное отношение Трампа к Уитмер за закрытие ее штата. « освободите Мичиган !» — однажды написал в Твиттере президент.
ФБР. узнал о схеме и арестовал заговорщиков в октябре. В своем заявлении Уитмер особо выделил Трампа, который в недавних дебатах с Байденом отказался прямо осудить правое крыло насилия, основанного на превосходстве белой расы.«Слова имеют значение, — сказала она. «Когда наши лидеры встречаются с внутренними террористами и поощряют их, они узаконивают свои действия и являются соучастниками».
История и влияние планируемого родительства
В 1916 году идея планируемого отцовства зародилась в первой клинике по контролю над рождаемостью в Браунсвилле, Бруклин. Сегодня членские организации Planned Parenthood управляют более чем 600 медицинскими центрами по всей территории Соединенных Штатов, а Planned Parenthood является ведущим национальным провайдером и сторонником высококачественного и доступного медицинского обслуживания для женщин, мужчин и молодежи.Программа «Планируемое отцовство» также является крупнейшим в стране поставщиком услуг сексуального просвещения.
Маргарет Сэнджер
Замечания президента службы планирования семьи Алексис Макгилл Джонсон о Маргарет Сэнджер — видео ИсторияPlanned Parenthood уходит корнями в историю медсестры по имени Маргарет Сэнджер. Сэнгер вырос в ирландской семье из 11 детей в Корнинге, Нью-Йорк. Ее мать, у которой было слабое здоровье в результате многих беременностей, в том числе семи выкидышей, умерла в возрасте 50 лет от туберкулеза.История ее матери, а также ее работа медсестрой в Нижнем Ист-Сайде Нью-Йорка вдохновили Сэнгер на поездку в Европу и изучение методов контроля рождаемости в то время, когда в Соединенных Штатах обучение людей контролю над рождаемостью было незаконным.
16 октября 1916 года Сэнгер вместе со своей сестрой Этель Бирн и активисткой Фанией Минделл открыла первую в стране клинику по контролю над рождаемостью в Браунсвилле, Бруклин. Женщины выстроились в ряд, чтобы получить информацию и советы по контролю над рождаемостью от Сэнгера, Бирна и Минделла.
Девять дней спустя полиция ворвалась в клинику и закрыла ее. Всем трем женщинам были предъявлены обвинения в преступлениях, связанных с распространением информации о контроле над рождаемостью. Сэнгер отказалась платить штраф и провела 30 дней в тюрьме, где рассказывала другим заключенным о контроле над рождаемостью.
Хотя клиника в Браунсвилле была закрыта, Сэнджер продолжила поездку по стране, чтобы поделиться своим видением — видением, в котором были очень вредные слепые пятна.
Сэнгер верил в евгенику — расистскую и эйблистскую идеологию, которая клеймила некоторых людей неспособными иметь детей.Евгеника — это теория, согласно которой общество можно улучшить путем планомерного разведения «желаемых качеств», таких как интеллект и трудолюбие. В начале 20 века евгенические идеи были популярны среди высокообразованных, привилегированных и в основном белых американцев. Маргарет Сэнджер неоднократно заявляла о своей вере в движение евгеники и о своей приверженности к нему в своих трудах, особенно в научном журнале Birth Control Review. Время от времени Зангер пытался отстаивать евгенику, которая не применялась по признаку расы или религии.Но в обществе, построенном на вере в превосходство белых, физическая и умственная подготовка всегда оценивается по расе. Следовательно, евгеника по своей природе расистская. Она считала, что с самого начала подрывала ее движение за репродуктивную свободу и причиняла вред бесчисленному количеству людей.
Сэнгер была настолько увлечена своей миссией — защищать контроль над рождаемостью, что решила присоединиться к идеям и организациям, которые были сторонниками эйблистов и сторонников превосходства белой расы. В 1926 году она говорила с женским помощником Ку-клукс-клана (KKK) на митинге в Нью-Джерси, посвященном методам контроля рождаемости.Сэнгер поддержал решение Бак против Белла 1927 года, в котором Верховный суд постановил, что штаты могут принудительно стерилизовать людей, считающихся «непригодными», без их согласия, а иногда и без их ведома. Принятие этого решения Сэнгером и другими идейными лидерами заложило основу для стерилизации десятков тысяч людей, часто против их воли.
В результате такого выбора движение за репродуктивные права во многих случаях усугубило расовую несправедливость в системе здравоохранения.Сфера современной гинекологии была основана Дж. Марион Симс, которая в середине 1800-х годов неоднократно и насильственно проводила инвазивные эксперименты на порабощенных чернокожих женщинах без анестезии. В 1939 году Сэнгер начал то, что называлось «негритянским проектом» — вместе с черными лидерами, такими как W.E.B. Дюбуа, Мэри МакЛеод Бетьюн и преподобный Адам Клейтон Пауэлл. Задача негритянского проекта заключалась в том, чтобы поставить чернокожих врачей и медсестер в ведение клиник по контролю над рождаемостью, чтобы уменьшить недоверие к расистской системе здравоохранения. Сэнгер потеряла контроль над проектом, и чернокожих женщин отправляли к белым врачам для контроля рождаемости и последующих посещений, что усугубило расистские и патерналистские проблемы здравоохранения на Юге.По сей день, переживания и боль чернокожих женщин слишком часто игнорируются или игнорируются врачами и другими поставщиками медицинских услуг, что, наряду с исторической дегуманизацией чернокожих, приводит к ошеломляющим различиям в результатах для здоровья, которых можно избежать.
Planned Parenthood считает, что все люди — любой расы, религии, гендерной идентичности, способностей, иммиграционного статуса и географии — являются полноценными людьми с правом определять свое будущее и решать, без принуждения или суждения, следует ли и когда иметь дети.Расизм и вера Маргарет Сэнджер в евгенику прямо противоречат миссии Planned Parenthood. Программа «Планируемое отцовство» осуждает веру Маргарет Сэнджер в евгенику. Кроме того, «Планируемое отцовство» осуждает историю и наследие борьбы с чернокожими в гинекологии и движение за репродуктивные права, а также жестокое обращение, которое продолжается в отношении чернокожих, коренных жителей и других цветных людей в этой стране.
НачалоВ 1923 году Сэнгер открыл Бюро клинических исследований по контролю над рождаемостью на Манхэттене, чтобы предоставить женщинам средства контроля над рождаемостью и собрать статистические данные о безопасности и долгосрочной эффективности контроля над рождаемостью.В том же году Сэнджер учредил Американскую лигу контроля над рождаемостью, новую амбициозную организацию, изучавшую глобальные последствия роста населения, разоружения и голода. Две организации в конечном итоге объединились в Федерацию планируемого родительства® Америки, Inc. (PPFA®).
Усилия сторонников контроля над рождаемостью привели в 1936 году к постановлению суда, согласно которому устройства и информация для контроля рождаемости больше не будут классифицироваться как непристойные и могут быть законно распространены в Нью-Йорке, Коннектикуте и Вермонте.Хотя потребовалось еще 30 лет, чтобы эти права были распространены на супружеские пары (но только супружеские пары) по всей остальной части страны, это был исторический шаг на пути к тому, чтобы контроль над рождаемостью стал доступным для всех.
Развитие таблетки
Кэтрин Декстер МакКормик, лидер избирательного движения и Лиги женщин-избирательниц, возглавляла исследовательский процесс и его основной спонсор.
В 1956 году в Пуэрто-Рико было проведено первое крупномасштабное испытание противозачаточных таблеток на людях.В то время этот шаг имел решающее значение для разработки таблеток, но испытания, проведенные на пуэрториканских женщинах, проводились без осознанного согласия. В судебном процессе приняли участие 1500 пуэрториканских женщин. Им сказали только, что препарат предотвращает беременность, а не то, что это экспериментальный препарат или что они могут вызвать потенциально опасные побочные эффекты. Таблетки, использованные в испытании, имели уровень гормонов в 20 раз выше, чем имеющиеся на рынке сегодня противозачаточные таблетки.
После этого и других испытаний таблетка была усовершенствована и превратилась в безопасный и эффективный метод контроля над рождаемостью, которым сегодня пользуются миллионы женщин.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило продажу таблеток для контрацепции 9 мая 1960 года. В течение пяти лет каждая четвертая замужняя женщина в США в возрасте до 45 лет принимала таблетки.
В то время как принятие репродуктивных прав в Штатах шло медленно, глобальный прогресс был быстрым. В Бомбее Международная федерация планируемого родительства (IPPF) была основана на 3-й Международной конференции по планируемому отцовству. Маргарет Сэнджер была ее президентом с 1952 по 1959 год.Сегодня Федерация планируемого родительства Америки является членом IPPF в США.
A New Era для женщин
Таблетка скоро изменит жизнь женщин и семей в США и во всем мире как простой, эффективный и обратимый способ предотвратить беременность. Но таблетки по-прежнему не продавались по всей стране. В некоторых штатах запрещены все формы контрацепции.
Семь лет спустя, в 1972 году, Верховный суд США отменил закон штата Массачусетс, запрещавший распространение противозачаточных средств среди неженатых людей в деле Eisenstadt v.Бэрд. Итак, к началу 70-х годов любому — холостому или женатому — было разрешено получать противозачаточные средства от своего врача.
В 1970 г. вступил в силу раздел X Закона об услугах общественного здравоохранения. Он установил государственное финансирование программ планирования семьи и полового воспитания в США, что означало, что организации Planned Parenthood и другие организации репродуктивного здоровья могли предоставлять услуги по контролю рождаемости и половому воспитанию большему количеству людей, особенно в сообществах с низкими доходами. По сей день финансирование по Разделу X имеет решающее значение для доступа к услугам по охране сексуального и репродуктивного здоровья.
К началу 1970-х годов роль женщин в общественной жизни начала меняться, и появилось движение за безопасные и легальные аборты. Штат за штатом меняли свои законы, разрешая аборты в определенных случаях. После того, как в 1970 году аборты были легализованы в Нью-Йорке, центр планирования семьи в Сиракузах, штат Нью-Йорк, стал первым центром планирования семьи, предлагающим услуги по прерыванию беременности.
В 1973 году Верховный суд вынес решение в пользу права на аборт в историческом деле Роу против Уэйда, сославшись на право на неприкосновенность частной жизни.Роу против Уэйда гарантировали право на безопасный и легальный аборт в течение первых трех месяцев беременности во всех 50 штатах. Роу против Уэйда остается законом сегодня.
Последовала недолгая, но решающая эра расширения прав на аборт. Законы, требующие согласия супруга на аборт, и строгие правила согласия родителей для несовершеннолетних, желающих сделать аборт, были вскоре отменены в судах, устранив вредные препятствия для аборта.
Однако в 1976 году Поправка Хайда сделала незаконным для людей, которые получают медицинскую страховку через Medicaid, использовать свою страховку для покрытия аборта, за исключением некоторых обстоятельств, таких как случаи изнасилования, инцеста или опасной для жизни беременности.Таким образом, даже несмотря на то, что аборт оставался легальным, он становился недоступным для людей с низким доходом, нуждающихся в финансовой помощи, или для тех, кто получает медицинскую помощь через Medicaid или Medicare.
Благодаря юридическим победам и неудачам, Planned Parenthood продолжала расти в своей роли надежного поставщика услуг в области сексуального и репродуктивного здоровья и педагога, создавая филиалы в сообществах по всей стране и становясь ведущим защитником в борьбе за репродуктивные права.
Победы и насилиеЭкстремисты устраивали кампании запугивания пациентов и совершали акты насилия, в том числе убийства, против лиц, производящих аборт, а также взрывы и поджоги в медицинских центрах.
Кроме того, противники безопасных и легальных абортов начали приобретать сильное политическое влияние. Рейган и Джордж Х.В. Президентство Буша привело к серьезным неудачам в движении за репродуктивные права. В 1992 году Верховный суд подтвердил конституционное право на аборт, но разрешил штатам вводить свои собственные правила в отношении абортов.«Планируемое отцовство против Кейси» разрешило штатам устанавливать ограничения на аборты — например, обязательные периоды ожидания более 24 часов, — что затрудняло доступ пациентов к медицинской помощи по прерыванию беременности.
В это время были приняты законы, ограничивающие федеральное финансирование поставщиков медицинских услуг и организаций, которые обсуждали аборты со своими пациентами, включая правило «кляпа» в Разделе X и политику города Мехико, или «глобальное правило кляпа». В 1993 году администрация Клинтона отменила эти правила — но это был не последний раз, когда мир страдал от правила глобального затыкания.
Но в эти трудные времена организация Planned Parenthood оставалась непоколебимой в своих обязательствах перед пациентами и в своем видении мира без препятствий для оказания помощи в области сексуального и репродуктивного здоровья.
В 1987 году организация Planned Parenthood начала предлагать бесплатное или недорогое тестирование на ВИЧ в общинах по всей стране. В 1989 году миллионы людей вышли на Вашингтон в поддержку репродуктивных прав. В том же году президент Американской федерации планируемого родительства Фэй Уоттлтон основала Фонд действий по планированию отцовства, организацию 501 (c) (4), для участия в кампаниях по просвещению населения, организации на низовом уровне, а также в законодательной и избирательной деятельности.
На протяжении 1990-х гг. «Планируемое отцовство» и другие эксперты по репродуктивному здоровью успешно выступали за одобрение FDA новых эффективных методов контроля рождаемости, включая прививку для контроля рождаемости, кольцо, пластырь и имплант. В 1999 году FDA одобрило план B для экстренной контрацепции, и компания Planned Parenthood начала работу по широкому распространению экстренной контрацепции в своих медицинских центрах и просвещению населения по вопросам экстренной контрацепции, также известной как «таблетка на следующее утро».”
В 1996 году организация «Планируемое отцовство» открыла сайт www.plannedparenthood.org, что сделало экспертную информацию о репродуктивном и сексуальном здоровье легко доступной для всех. Сегодня 76 миллионов человек ежегодно пользуются онлайн-доступом к программе «Планируемое отцовство».
Новое тысячелетие, второй векВ 2000 году FDA одобрило мифепристон, известный как медикаментозный аборт или таблетка для прерывания беременности, после нескольких лет отсрочек из-за политической оппозиции. Центры здоровья по программе «Планируемое отцовство» смогли предложить еще один безопасный и эффективный вариант для пациентов, обращающихся за абортом.
В 2005 году первая дочерняя компания Planned Parenthood начала проводить заместительную гормональную терапию (ЗГТ) для трансгендерных пациентов. В 2006 году вакцина против ВПЧ была одобрена, и медицинские центры планирования семьи начали предоставлять этот спасительный метод профилактики рака в медицинских центрах по всей стране. В том же году экстренная контрацепция Plan B стала доступна для покупки без рецепта женщинам в возрасте 18+. (В 2013 году Plan B и аналогичные бренды стали доступны без рецепта для людей всех возрастов.)
Но эти достижения сдерживались политическим климатом, который становился все более враждебным по отношению к охране репродуктивного здоровья. Администрация Джорджа Буша восстановила глобальное правило кляпа, воодушевила противников безопасных и легальных абортов, запретив редко используемые процедуры абортов на поздних стадиях, и работала над установлением нового правового статуса для замороженных эмбрионов. Увеличилось финансирование сексуального просвещения по принципу «только воздержание», в результате чего учащиеся по всей стране остались без точной с медицинской точки зрения информации о сексуальном здоровье.
В 2009 году администрация Обамы отменила глобальное правило кляпов и подтвердила приверженность Америки охране сексуального и репродуктивного здоровья дома и за рубежом. В 2010 году был принят Закон о доступном медицинском обслуживании. Это расширило доступ к медицинскому страхованию, позволив большему количеству людей получать необходимое медицинское обслуживание. Закон включает положение, которое требует, чтобы планы страхования покрывали услуги по контролю над рождаемостью и профилактические услуги, такие как обследование на рак и тестирование на ЗППП. Программа Planned Parenthood работала над ознакомлением 300 000 человек с новым законом о медицинском страховании, помогая им получить страховое покрытие.
После нескольких лет введения государством ограничений на аборты в 2016 году Верховный суд постановил, что штаты не могут создавать правила, которые возлагают «чрезмерное бремя» на людей, обращающихся за абортом, в деле «Здоровье всей женщины против Хеллерстедта» — победа для тех, кто выступает за безопасный и легальный аборт.